
Los metales , y específicamente los elementos de tierras raras , forman numerosos complejos químicos con el boro . Su estructura cristalina y su enlace químico dependen en gran medida del elemento metálico M y de su relación atómica con el boro. Cuando la relación B/M supera 12, los átomos de boro forman icosaedros B 12 que se unen en una estructura tridimensional de boro, y los átomos de metal residen en los huecos de esta estructura. [1] Esos icosaedros son unidades estructurales básicas de la mayoría de los alótropos del boro y de los boruros de tierras raras ricos en boro . En dichos boruros, los átomos de metal donan electrones a los poliedros de boro y, por lo tanto, estos compuestos se consideran sólidos deficientes en electrones .
Las estructuras cristalinas de muchos boruros ricos en boro se pueden atribuir a ciertos tipos, incluidos MgAlB 14 , YB 66 , REB 41 Si 1.2 , B 4 C y otros tipos más complejos como RE x B 12 C 0.33 Si 3.0 . Algunas de estas fórmulas, por ejemplo B 4 C, YB 66 y MgAlB 14 , reflejan históricamente las estructuras idealistas, mientras que la composición determinada experimentalmente no es estequiométrica y corresponde a índices fraccionarios. Los boruros ricos en boro generalmente se caracterizan por celdas unitarias grandes y complejas , que pueden contener más de 1500 sitios atómicos y presentan estructuras extendidas en forma de "tubos" y grandes poliedros modulares ("superpoliedros"). Muchos de esos sitios tienen ocupación parcial, lo que significa que la probabilidad de encontrarlos ocupados con un cierto átomo es menor que uno y, por lo tanto, solo algunos de ellos están llenos de átomos. El escandio se distingue entre los elementos de tierras raras porque forma numerosos boruros con tipos de estructura poco comunes; esta propiedad del escandio se atribuye a sus radios atómicos e iónicos relativamente pequeños.
Los cristales del boruro de tierras raras específico YB 66 se utilizan como monocromadores de rayos X para seleccionar rayos X con ciertas energías (en el rango de 1-2 keV) fuera de la radiación de sincrotrón . Otros boruros de tierras raras pueden encontrar aplicación como materiales termoeléctricos , debido a su baja conductividad térmica ; esto último se origina a partir de su estructura cristalina compleja, "amorfa".
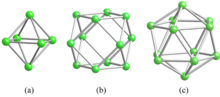
En los boruros metálicos, la unión del boro varía dependiendo de la relación atómica B/M. Los diboruros tienen B/M = 2, como en el conocido superconductor MgB 2 ; cristalizan en una estructura en capas hexagonal de tipo AlB 2 . Los hexaboruros tienen B/M = 6 y forman una estructura tridimensional de boro basada en un octaedro de boro (Fig. 1a). Los tetraboruros, es decir, B/M = 4, son mezclas de estructuras de diboruro y hexaboruro. El cuboctaedro (Fig. 1b) es la unidad estructural de los dodecaboruros, que tienen una red cúbica y B/M = 12. Cuando la relación de composición supera 12, el boro forma icosaedros B 12 (Fig. 1c) que se unen en una estructura tridimensional de boro, y los átomos de metal residen en los huecos de esta estructura. [2] [3] [4]
Este complejo comportamiento de enlace se origina del hecho de que el boro tiene solo tres electrones de valencia; esto dificulta el enlace tetraédrico como en el diamante o el enlace hexagonal como en el grafito . En cambio, los átomos de boro forman poliedros . Por ejemplo, tres átomos de boro forman un triángulo donde comparten dos electrones para completar el llamado enlace de tres centros. Los poliedros de boro, como el octaedro B6 , el cuboctaedro B12 y el icosaedro B12 , carecen de dos electrones de valencia por poliedro para completar la estructura del marco basada en poliedros. Los átomos de metal necesitan donar dos electrones por poliedro de boro para formar boruros metálicos ricos en boro. Por lo tanto, los compuestos de boro a menudo se consideran sólidos deficientes en electrones. La naturaleza de enlace covalente de los compuestos de boruros metálicos también les da su dureza y propiedad de reactividad química inerte. [5]
Los compuestos icosaédricos B 12 incluyen [3] boro α-romboédrico (B 13 C 2 ), boro β-romboédrico (MeB x , 23≤x), boro α-tetragonal (B 48 B 2 C 2 ), boro β-tetragonal (β-AlB 12 ), [6] AlB 10 o AlC 4 B 24 , YB 25 , YB 50 , YB 66 , NaB 15 o MgAlB 14 , γ-AlB 12 , [6] BeB 3 [7] y SiB 6 . [8]

El YB 25 y el YB 50 se descomponen sin fundirse, lo que dificulta su crecimiento como monocristales mediante el método de zona flotante . Sin embargo, la adición de una pequeña cantidad de Si resuelve este problema y da como resultado monocristales [9] con la estequiometría de YB 41 Si 1.2 . [10] Esta técnica de estabilización permitió la síntesis de algunos otros boruros de tierras raras ricos en boro.
Albert y Hillebrecht revisaron compuestos binarios y ternarios seleccionados de boro que contienen elementos del grupo principal, a saber, boruros de metales alcalinos y alcalinotérreos, boruros de aluminio y compuestos de boro y los no metales C, Si, Ge, N, P, As, O, S y Se. [11] Sin embargo, excluyeron los boruros de tierras raras basados en icosaedros descritos aquí. Nótese que los elementos de tierras raras tienen electrones d y f que complican las propiedades químicas y físicas de sus boruros. Werheit et al. revisaron los espectros Raman de numerosos compuestos de boro basados en icosaedros. [12]
La figura 2 muestra una relación entre el radio iónico de los iones de tierras raras trivalentes y la composición de algunos boruros de tierras raras. Nótese que el escandio tiene muchos compuestos de boro únicos, como se muestra en la figura 2, debido al radio iónico mucho más pequeño en comparación con otros elementos de tierras raras. [4] [13]
Para comprender las estructuras cristalinas de los boruros de tierras raras, es importante tener en cuenta el concepto de ocupación parcial del sitio, es decir, algunos átomos en las celdas unitarias descritas a continuación pueden tomar varias posiciones posibles con una probabilidad estadística dada. Por lo tanto, con la probabilidad estadística dada, algunos de los sitios de ocupación parcial en dicha celda unitaria están vacíos y los sitios restantes están ocupados. [14]
Los compuestos que históricamente recibieron las fórmulas REAlB 14 y REB 25 tienen la estructura MgAlB 14 con una simetría ortorrómbica y un grupo espacial Imma (No. 74). En esta estructura, los átomos de tierras raras ingresan al sitio Mg. Los sitios de aluminio están vacíos para REB 25. Ambos sitios metálicos de la estructura REAlB 14 tienen ocupaciones parciales de alrededor del 60-70%, lo que demuestra que los compuestos en realidad no son estequiométricos. La fórmula REB 25 simplemente refleja la relación atómica promedio [B]/[RE] = 25. Los boruros de itrio forman estructuras YAlB 14 e YB 25. Los experimentos han confirmado que los boruros basados en elementos de tierras raras desde Tb hasta Lu pueden tener la estructura REAlB 14 . [15] [16] [17] Un subconjunto de estos boruros, que contiene elementos de tierras raras desde Gd hasta Er , también puede cristalizar en la estructura REB 25. [18]
Korsukova et al. analizaron la estructura cristalina de YAlB 14 utilizando un monocristal cultivado mediante el método de crecimiento en solución a alta temperatura. Las constantes de red se dedujeron como a = 0,58212(3), b = 1,04130(8) y c = 0,81947(6) nm, y las coordenadas atómicas y las ocupaciones de los sitios se resumen en la tabla I. [16]

La figura 3 muestra la estructura cristalina de YAlB 14 vista a lo largo del eje x . Las esferas negras grandes son átomos de Y, las esferas azules pequeñas son átomos de Al y las esferas verdes pequeñas son los sitios de puente de boro; los grupos de B 12 se representan como los icosaedros verdes. La estructura de boro de YAlB 14 es una de las más simples entre los boruros basados en icosaedros: consta de un solo tipo de icosaedro y un sitio de puente de boro. El sitio de puente de boro está coordinado tetraédricamente por cuatro átomos de boro. Esos átomos son otro átomo de boro en el sitio del contrapuente y tres átomos de boro ecuatoriales de uno de los tres icosaedros de B 12. Los átomos de aluminio están separados por 0,2911 nm y están dispuestos en líneas paralelas al eje x , mientras que los átomos de itrio están separados por 0,3405 nm. Tanto los átomos de Y como los icosaedros B 12 forman zigzags a lo largo del eje x . Los átomos de boro que forman el puente conectan tres átomos de boro ecuatorial de tres icosaedros y estos forman una red paralela al plano cristalino (101) ( plano x - z en la figura). La distancia de enlace entre el boro que forma el puente y los átomos de boro ecuatorial es de 0,1755 nm, lo que es típico para el fuerte enlace covalente BB (longitud de enlace 0,17-0,18 nm); por lo tanto, los átomos de boro que forman el puente fortalecen los planos de red individuales. Por otro lado, la gran distancia entre los átomos de boro dentro del puente (0,2041 nm) sugiere una interacción más débil y, por lo tanto, los sitios de puente contribuyen poco a la unión entre los planos de red. [16] [17]
La estructura de boro de YAlB 14 necesita la donación de cuatro electrones de elementos metálicos: dos electrones para un icosaedro B 12 y un electrón para cada uno de los dos átomos de boro puente, para apoyar su coordinación tetraédrica. La composición química real de YAlB 14 , determinada por el análisis de la estructura, es Y 0,62 Al 0,71 B 14 como se describe en la tabla I . Si ambos elementos metálicos son iones trivalentes, entonces se pueden transferir 3,99 electrones a la estructura de boro, que es muy cercano al valor requerido de 4. Sin embargo, debido a que el enlace entre los átomos de boro puente es más débil que en un enlace covalente BB típico, se donan menos de 2 electrones a este enlace, y los átomos de metal no necesitan ser trivalentes. Por otra parte, la transferencia de electrones desde los átomos de metal a la estructura de boro implica que no solo el fuerte enlace covalente BB dentro de la estructura sino también la interacción iónica entre los átomos de metal y la estructura contribuyen a la estabilización de la fase YAlB 14. [16]
Además del itrio, una amplia gama de elementos de tierras raras desde Nd hasta Lu , excepto Eu , pueden formar compuestos REB 66. [20] Seybolt descubrió el compuesto YB 66 en 1960 [21] y su estructura fue resuelta por Richards y Kasper en 1969. [22] Informaron que YB 66 tiene una estructura cúbica centrada en las caras con grupo espacial Fm 3 c (No. 226) y constante reticular a = 2,3440(6) nm. Hay 13 sitios de boro B1–B13 y un sitio de itrio. Los sitios B1 forman un icosaedro y los sitios B2–B9 forman otro icosaedro. Estos icosaedros se organizan en una unidad de trece icosaedros (B 12 ) 12 B 12 que se muestra en la figura 4a y se llama supericosaedro. El icosaedro formado por los átomos del sitio B1 se encuentra en el centro del supericosaedro. El supericosaedro es una de las unidades básicas de la estructura de boro de YB 66 . Existen dos tipos de supericosaedros: uno ocupa los centros de las caras cúbicas y otro, que está rotado 90°, se ubica en el centro de la celda y en los bordes de la misma. Por lo tanto, hay ocho supericosaedros (1248 átomos de boro) en la celda unitaria. [19]

Otra unidad estructural de YB 66 , mostrada en la figura 4b, es el grupo B 80 de 80 sitios de boro formados por los sitios B10 a B13. [19] Todos esos 80 sitios están parcialmente ocupados y en total contienen solo alrededor de 42 átomos de boro. El grupo B 80 está ubicado en el centro del cuerpo del octante de la celda unitaria, es decir, en la posición 8 a (1/4, 1/4, 1/4); por lo tanto, hay ocho grupos de este tipo (336 átomos de boro) por celda unitaria. Dos análisis de estructura independientes [19] [22] llegaron a la misma conclusión de que el número total de átomos de boro en la celda unitaria es 1584. La estructura del marco de boro de YB 66 se muestra en la figura 5a. Para indicar las orientaciones relativas de los supericosaedros, se muestra un dibujo esquemático en la figura 5b, donde los supericosaedros y los cúmulos B 80 están representados por esferas verde claro y verde oscuro, respectivamente; en la superficie superior de la celda unitaria, las orientaciones relativas de los supericosaedros están indicadas por flechas. Hay 48 sitios de itrio ((0,0563, 1/4, 1/4) para YB 62 [19] ) en la celda unitaria. Richards y Kasper fijaron la ocupación del sitio Y a 0,5, lo que dio como resultado 24 átomos de Y en la celda unitaria y la composición química de YB 66 . Como se muestra en la figura 6, los sitios Y forman un par separado por solo 0,264 nm en YB 62 . Este par está alineado normal al plano formado por cuatro supericosaedros. La ocupación del sitio Y 0,5 implica que el par siempre tiene un átomo de Y con un sitio vacío. [22]
Slack et al. informaron que el número total de átomos de boro en la celda unitaria, calculado a partir de los valores medidos de densidad, composición química y constante de red, es 1628 ± 4, [23] que es mayor que el valor 1584 obtenido del análisis estructural. [19] [22] El número de átomos de B en la celda unitaria permanece casi constante cuando la composición química cambia de YB 56 a YB 66 . Por otro lado, el número total de átomos de itrio por celda unitaria varía y es, por ejemplo, ~26,3 para YB 62 (ver tabla de la derecha). Si el número total de átomos de Y se mantiene por debajo o igual a 24, entonces es posible que un átomo de Y se acomode en cada par Y (ocupación parcial). Sin embargo, el valor experimental de 26,3 excede significativamente 24 y, por lo tanto, ambos sitios del par podrían estar ocupados. En este caso, debido a la pequeña separación entre los dos átomos de Y, deben ser repelidos por la fuerza de Coulomb . Para aclarar este punto, se introdujeron sitios Y divididos en el análisis de la estructura, lo que resultó en una mejor concordancia con el experimento. [24] Las distancias y ocupaciones del sitio Y se presentan en la tabla de la izquierda.
Hay veinte sitios de pares Y con un átomo Y y tres pares con dos átomos Y; también hay un par Y vacío (ocupación parcial = 0). La separación de 0,340 nm para el sitio del par Y2 (dos átomos Y en el sitio del par) es mucho mayor que la separación de 0,254 nm para el sitio del par Y1 (un átomo Y en el sitio del par), como se esperaba. El número total de átomos Y en la celda unitaria es 26,3, exactamente como se midió. Ambos casos se comparan en la figura 7. La mayor separación para el sitio del par Y2 es clara en comparación con la del sitio del par Y1. En el caso del par Y2, algunos sitios de boro vecinos que pertenecen al grupo B 80 deben estar desocupados porque están demasiado cerca del sitio Y2. [24]
La división del sitio Y produce el número correcto de átomos de Y en la celda unitaria, pero no de átomos de B. No solo la ocupación de los sitios B en el grupo B 80 debe depender en gran medida de si el sitio Y es el estado Y1 o el estado Y2, sino que también la posición de los sitios B ocupados debe verse afectada por el estado del sitio Y. [24] Las coordenadas atómicas y las ocupaciones de los sitios se resumen en la tabla II .
De manera similar al itrio, los metales de tierras raras desde Gd hasta Lu pueden formar boruro de tipo REB 41 Si 1.2 . El primer compuesto de este tipo se sintetizó mediante una reacción en estado sólido y su estructura se dedujo como YB 50 . [25] La difracción de rayos X en polvo (DRX) y la difracción de electrones indicaron que el YB 50 tiene una estructura ortorrómbica con constantes de red a = 1,66251(9), b = 1,76198 y c = 0,94797(3) nm. El grupo espacial se asignó como P 2 1 2 1 2. [25] Debido a la estrecha similitud en las constantes de red y el grupo espacial, se podría esperar que YB 50 tenga la estructura ortorrómbica de tipo γ-AlB 12 cuyas constantes de red y grupo espacial son a = 1,6573(4), b = 1,7510(3) y c = 1,0144(1) nm y P2 1 2 1 2. [26] YB 50 se descompone a ~1750 °C sin fundirse, lo que dificulta el crecimiento de monocristales a partir de la masa fundida. Una pequeña adición de silicio hizo que YB 50 se fundiera sin descomposición, y así permitió el crecimiento de monocristales a partir de la masa fundida [9] y el análisis de la estructura de monocristales. [10]
El análisis de la estructura indicó que el YB 41 Si 1.2 no tiene la red de tipo γ-AlB 12 sino una rara estructura cristalina ortorrómbica (grupo espacial: Pbam , No. 55) con constantes de red de a = 1,674(1) nm, b = 1,7667(1) nm y c = 0,9511(7) nm. [10] Hay 58 sitios atómicos independientes en la celda unitaria. Tres de ellos están ocupados por átomos de B o Si (sitios de ocupación mixta), uno es un sitio puente de Si y uno es un sitio Y. De los 53 sitios de boro restantes, 48 forman icosaedros y 5 son sitios puente. Las coordenadas atómicas y las ocupaciones de los sitios se resumen en la tabla III .
La estructura de boro de YB 41 Si 1.2 consta de cinco icosaedros B 12 (I1–I5) y un poliedro B 12 Si 3 que se muestra en la figura 8a. En la figura 8b se representa un enlace inusual, donde dos icosaedros B 12 -I5 se conectan a través de dos átomos B de cada icosaedro formando un cuadrado imperfecto. La estructura de boro de YB 41 Si 1.2 se puede describir como una estructura en capas donde dos redes de boro (figuras 9a,b) se apilan a lo largo del eje z . Una red de boro consta de 3 icosaedros I1, I2 e I3 y se encuentra en el plano z = 0; otra red consta del icosaedro I5 y el poliedro B 12 Si 3 y se encuentra en z = 0,5. El icosaedro I4 une estas redes y, por lo tanto, su altura a lo largo del eje z es 0,25. [10]
Los icosaedros I4 unen dos redes a lo largo del eje c y, por lo tanto, forman una cadena infinita de icosaedros a lo largo de este eje, como se muestra en la figura 10. Las distancias inusualmente cortas (0,4733 y 0,4788 nm) entre los icosaedros vecinos en esta dirección dan como resultado la constante de red del eje c relativamente pequeña de 0,95110(7) nm en este compuesto; otros boruros con una cadena icosaédrica similar tienen este valor mayor que 1,0 nm. Sin embargo, las distancias de enlace entre los átomos B del ápice (0,1619 y 0,1674 nm) de los icosaedros I4 vecinos son habituales para los boruros metálicos considerados. [10]
Otra característica inusual de YB 41 Si 1.2 es la ocupación del 100% del sitio Y. En la mayoría de los boruros metálicos basados en icosaedros, los sitios metálicos tienen una ocupación del sitio bastante baja, por ejemplo, alrededor del 50% para YB 66 y del 60-70% para REAlB 14 . Cuando el sitio Y es reemplazado por elementos de tierras raras, REB 41 Si 1.2 puede tener un ordenamiento similar al antiferromagnético debido a esta alta ocupación del sitio. [27] [28] [29]
Los boruros de tierras raras REB 15.5 CN, REB 22 C 2 N y REB 28.5 C 4 son homólogos, es decir, tienen una estructura cristalina similar, a B 4 C . Este último tiene una estructura típica de los boruros basados en icosaedros, como se muestra en la figura 11a. Allí, los icosaedros B 12 forman una unidad reticular romboédrica (grupo espacial: R 3 m (n.º 166), constantes reticulares: a = 0,56 nm y c = 1,212 nm) que rodea una cadena CBC que reside en el centro de la unidad reticular, y ambos átomos de C forman un puente entre los tres icosaedros vecinos. Esta estructura está en capas: como se muestra en la figura 11b, los icosaedros B 12 y los carbonos puente forman un plano de red que se extiende paralelo al plano c y se apila a lo largo del eje c .
Estos compuestos homólogos tienen dos unidades estructurales básicas: el icosaedro B 12 y el octaedro B 6 . El plano de la red de la estructura B 4 C se puede reemplazar periódicamente por una capa de octaedro B 6 de modo que el reemplazo de cada tercera, cuarta y quinta capa correspondería a REB 15.5 CN, REB 22 C 2 N y REB 28.5 C 4 , respectivamente. El octaedro B 6 es más pequeño que el icosaedro B 12 ; por lo tanto, los elementos de tierras raras pueden residir en el espacio creado por el reemplazo. Las secuencias de apilamiento de B 4 C, REB 15.5 CN, REB 22 C 2 N y REB 28.5 C 4 se muestran en las figuras 12a, b, c y d, respectivamente. Las imágenes reticulares de microscopía electrónica de transmisión de alta resolución (HRTEM) de los últimos tres compuestos, agregadas a la Fig. 12, confirman la secuencia de apilamiento de cada compuesto. Los símbolos 3T, 12R y 15R entre paréntesis indican el número de capas necesarias para completar la secuencia de apilamiento, y T y R se refieren a estructuras trigonales y romboédricas. Por lo tanto, REB 22 C 2 N y REB 28.5 C 4 tienen constantes de red c bastante grandes .
Debido al pequeño tamaño de los octaedros B 6 , no pueden interconectarse. En cambio, se unen a los icosaedros B 12 en la capa vecina, y esto disminuye la fuerza de enlace en el plano c . Los átomos de nitrógeno fortalecen el enlace en el plano c al unir tres icosaedros, como los átomos de C en la cadena CBC. La Figura 13 representa la red del plano c que revela el puente alternativo de los icosaedros de boro por átomos de N y C. La disminución del número de octaedros B 6 disminuye el papel del nitrógeno porque las cadenas CBC comienzan a unir los icosaedros. Por otro lado, en MgB 9 N la capa del octaedro B 6 y la capa del icosaedro B 12 se apilan alternativamente y no hay cadenas CBC; [32] por lo tanto, solo los átomos de N unen los icosaedros B 12. Sin embargo, los compuestos REB 9 N aún no se han identificado.
Se confirma que Sc, Y, Ho, Er, Tm y Lu forman compuestos de tipo REB 15.5 CN. [33] El análisis de la estructura de un solo cristal arrojó simetría trigonal para ScB 15.5 CN (grupo espacial P 3 m1 (No.164) con a = 0,5568(2) y c = 1,0756(2) nm), y las coordenadas atómicas deducidas se resumen en la tabla IVa .
REB 22 C 2 N se sintetizó para Y, Ho, Er, Tm y Lu. [34] La estructura cristalina, resuelta para un compuesto representativo YB 22 C 2 N, pertenece al grupo trigonal con grupo espacial R 3 m (No.166); tiene seis unidades de fórmula en la celda unitaria y constantes de red a = b = 0,5623(0) nm y c = 4,4785(3) nm. Las coordenadas atómicas de YB 22 C 2 N se resumen en la tabla IVb .
Y, Ho, Er, Tm y Lu también forman REB 28.5 C 4 que tiene una estructura cristalina trigonal con grupo espacial R 3 m (No. 166). [30] Las constantes de red del compuesto representativo YB 28.5 C 4 son a = b = 0,56457(9) nm y c = 5,68873(13) nm y hay seis unidades de fórmula en la celda unitaria. Los datos de estructura de YB 28.5 C 4 se resumen en la tabla IVc .

Inicialmente, estos se describieron como compuestos ternarios RE-B-Si, [36] [37] [38] pero más tarde se incluyó el carbono para mejorar la descripción de la estructura que resultó en una composición cuaternaria RE-BC-Si. [35] RE x B 12 C 0.33 Si 3.0 (RE=Y y Gd–Lu) tienen una estructura cristalina única con dos unidades: un grupo de icosaedros B 12 y un complejo similar al etano Si 8 , y una configuración de enlace (B 12 ) 3 ≡Si-C≡(B 12 ) 3 . Un compuesto representativo de este grupo es Y x B 12 C 0.33 Si 3.0 (x=0.68). Tiene una estructura cristalina trigonal con grupo espacial R 3 m (No. 166) y constantes reticulares a = b = 1,00841(4) nm, c = 1,64714(5) nm, α = β = 90° y γ = 120°. [36]

El cristal tiene una estructura en capas. La figura 15 muestra una red de icosaedros de boro que se extiende en paralelo al plano (001), conectándose con cuatro vecinos a través de enlaces B1–B1. Los átomos del sitio C3 y Si3 fortalecen la red al unir los icosaedros de boro. A diferencia de otros compuestos icosaédricos ricos en boro, los icosaedros de boro de diferentes capas no están unidos directamente. Los icosaedros dentro de una capa están unidos a través de grupos similares al Si8etano con enlaces (B12 ) 3 ≡Si -C≡(B12 ) 3 , como se muestra en las figuras 16a y b. [36]
Hay ocho sitios atómicos en la celda unitaria: un sitio de itrio Y, cuatro de boro B1–B4, un sitio de carbono C3 y tres sitios de silicio Si1–Si3. Las coordenadas atómicas, la ocupación del sitio y los factores de desplazamiento isotrópico se enumeran en la tabla Va ; el 68% de los sitios Y están ocupados aleatoriamente y los sitios Y restantes están vacantes. Todos los sitios de boro y los sitios Si1 y Si2 están completamente ocupados. Los sitios C3 y Si3 pueden estar ocupados por átomos de carbono o silicio (ocupación mixta) con una probabilidad de alrededor del 50%. Su separación es de solo 0,413 Å y, por lo tanto, están ocupados los sitios C3 o Si3, pero no ambos. Estos sitios forman pares Si-C, pero no pares Si-Si o CC. Las distancias entre los sitios C3 y Si3 y los sitios circundantes para Y x B 12 C 0,33 Si 3,0 se resumen en la tabla Vb y la estructura cristalina general se muestra en la figura 14. [35]
Salvador et al. [39] informaron de un compuesto de terbio isotípico Tb 3–x C 2 Si 8 (B 12 ) 3 . La mayoría de las partes de la estructura cristalina son las mismas que las descritas anteriormente; sin embargo, su configuración de enlace se deduce como (B 12 ) 3 ≡CC≡(B 12 ) 3 en lugar de (B 12 ) 3 ≡Si-C≡(B 12 ) 3 . Los autores añadieron carbono intencionalmente para hacer crecer los monocristales, mientras que los cristales anteriores se contaminaron accidentalmente con carbono durante su crecimiento. Por tanto, se consiguió una mayor concentración de carbono. La existencia de ambos esquemas de enlace de (B 12 ) 3 ≡Si-C≡(B 12 ) 3 y (B 12 ) 3 ≡CC≡(B 12 ) 3 sugiere una ocupación de los sitios de carbono del 50-100%. Por otra parte, el esquema de enlace (B 12 ) 3 ≡Si-Si≡(B 12 ) 3 es poco probable debido a la distancia Si-Si demasiado corta, lo que sugiere que la ocupación mínima de carbono en el sitio es del 50%. Algunos átomos de B pueden reemplazar a los átomos de C en el sitio C3, como se asignó previamente al sitio B. [38] Sin embargo, la ocupación de carbono es más probable porque el sitio está coordinado tetraédricamente, mientras que la ocupación del sitio por B necesita un electrón adicional para completar el enlace tetraédrico. Por lo tanto, el carbono es indispensable para este grupo de compuestos.

El escandio tiene los radios atómico e iónico (3+) más pequeños (1,62 y 0,885 Å, respectivamente) entre los elementos de tierras raras. Forma varios boruros basados en icosaedros que no se encuentran en otros elementos de tierras raras; sin embargo, la mayoría de ellos son compuestos ternarios Sc-BC. Hay muchas fases ricas en boro en la esquina rica en boro del diagrama de fases Sc-BC, como se muestra en la figura 17. [41] Una ligera variación de la composición puede producir ScB 19 , ScB 17 C 0,25 , ScB 15 C 0,8 y ScB 15 C 1,6 ; sus estructuras cristalinas son inusuales para los boruros y son muy diferentes entre sí. [40]
ScB 19+x Si y tiene una estructura cristalina tetragonal con grupo espacial P 4 1 2 1 2 (No. 92) o P 4 3 2 1 2 y constantes reticulares de a , b = 1.03081(2) y c = 1.42589(3) nm; es isotípico al tipo de estructura α-AlB 12 . [42] Hay 28 sitios atómicos en la celda unitaria, que están asignados a 3 átomos de escandio, 24 átomos de boro y un átomo de silicio. Las coordenadas atómicas, las ocupaciones de sitios y los factores de desplazamiento isotrópico se enumeran en la tabla VI .
La estructura de boro de ScB 19+x Si y se basa en un icosaedro B 12 y una unidad B 22. Esta unidad se puede observar en el boro β-tetragonal [43] y es una modificación de la unidad B 20 de α-AlB 12 [6] (o unidad B 19 en los primeros informes [44] [45] ). La unidad B 20 es un icosaedro maclado formado por los sitios B13 a B22 con dos sitios vacantes y un átomo B (B23) que une ambos lados de la unidad. El icosaedro maclado se muestra en la figura 18a. B23 se trató como un átomo aislado en los primeros informes; [44] [45] está unido a cada icosaedro maclado a través de B18 y a otro icosaedro a través del sitio B5. Si los icosaedros maclados fueran independientes sin maclado, entonces B23 sería un sitio puente que une tres icosaedros. Sin embargo, debido al maclado, B23 se desplaza más cerca del icosaedro maclado que otro icosaedro; por lo tanto, B23 se trata actualmente como un miembro del icosaedro maclado. En ScB 19+x Si y , los dos sitios B24 que corresponden a los sitios vacantes en la unidad B 20 están parcialmente ocupados; por lo tanto, la unidad debe denominarse un grupo B 22 que está ocupado por aproximadamente 20,6 átomos de boro. Los átomos de escandio ocupan 3 de los 5 sitios Al de α-AlB 12 , es decir, Sc1, Sc2 y Sc3 corresponden a los sitios Al4, Al1 y Al2 de α-AlB 12 , respectivamente. Los sitios Al3 y Al5 están vacíos para ScB 19+x Si y , y el sitio Si une dos unidades B 22 . Esta fase también existe sin silicio. [46]
La figura 19a muestra la red de icosaedros de boro en el marco de boro de ScB 19+x Si y . En esta red, 4 icosaedros forman un supertetraedro ( figura 18b); uno de sus bordes es paralelo al eje a , y los icosaedros en este borde forman una cadena a lo largo del eje a . El borde opuesto del supertetraedro es paralelo al eje b y los icosaedros en este borde forman una cadena a lo largo del eje b . Como se muestra en la figura 19, hay túneles anchos rodeados por la disposición de icosaedros a lo largo de los ejes a y b . Los túneles están llenos de las unidades B 22 que se unen fuertemente a los icosaedros circundantes; la conexión de las unidades B 22 es helicoidal y corre a lo largo del eje c como se muestra en la figura 19b. Los átomos de escandio ocupan los huecos en la red de boro como se muestra en la figura 19c, y los átomos de Si unen las unidades B22 .
Una cantidad muy pequeña de carbono es suficiente para estabilizar "ScB 17 C 0.25 ". [40] Este compuesto tiene un amplio rango de composición, a saber, ScB 16.5+x C 0.2+y con x ≤ 2.2 e y ≤ 0.44. ScB 17 C 0.25 tiene una estructura cristalina hexagonal con grupo espacial P6mmm (No. 199) y constantes de red a, b = 1.45501(15) nm y c = 0.84543(16) nm. [47]
Hay 19 sitios atómicos en la celda unitaria, que están asignados a un sitio de escandio Sc, 14 sitios de boro B1–B14 con una ocupación del 100%, dos sitios de ocupación mixta de boro-carbono B/C15 y B/C16, y dos sitios de boro de ocupación parcial B17 y B18. Las coordenadas atómicas, las ocupaciones de los sitios y los factores de desplazamiento isotrópico se enumeran en la tabla VII . Aunque una cantidad muy pequeña de carbono (¡menos del 2 % en peso!) juega un papel importante en la estabilidad de la fase, el carbono no tiene sus propios sitios sino que comparte con el boro dos sitios intersticiales B/C15 y B/C16.
Hay dos icosaedros B 12 no equivalentes, I1 e I2, que están formados por los sitios B1–B5 y B8–B12, respectivamente. Un "tubo" es otra unidad estructural característica de ScB 17 C 0.25 . Se extiende a lo largo del eje c y consta de los sitios B13, B14, B17 y B18 donde B13 y B14 forman anillos de 6 miembros. Los sitios B17 y B18 también forman anillos de 6 miembros; sin embargo, sus distancias mutuas (0,985 Å para B17 y 0,955 Å para B18) son demasiado cortas para una ocupación simultánea de los sitios vecinos. Por lo tanto, los átomos de boro ocupan el segundo sitio vecino formando un triángulo. Las ocupaciones de los sitios B17 y B18 deberían ser del 50%, pero el análisis de la estructura sugiere valores mayores. La estructura cristalina vista a lo largo del eje a se muestra en la figura 20, lo que sugiere que el ScB 17 C 0.25 es un material estratificado. Dos capas, construidas respectivamente por los icosaedros I1 e I2, se apilan alternativamente a lo largo del eje c . Sin embargo, el cristal ScB 17 C 0.25 no está estratificado. Por ejemplo, durante la fusión por arco, los cristales en forma de aguja de ScB 17 C 0.25 crecen violentamente a lo largo del eje c ; esto nunca sucede en compuestos estratificados. La estructura cristalina vista a lo largo del eje c se muestra en la figura 21a. Los icosaedros I1 e I2 forman un anillo centrado por el "tubo" que se muestra en la figura 21b, que probablemente rige las propiedades del cristal ScB 17 C 0.25 . Los sitios de ocupación mixta B/C15 y B/C16 interconectan los anillos. Se puede observar una similitud estructural entre ScB 17 C 0.25 y BeB 3 . [7]
Las figuras 22a y b presentan imágenes de red HRTEM y patrones de difracción de electrones tomados a lo largo de las direcciones cristalinas [0001] y [11 2 0], respectivamente. La imagen de red HRTEM de la figura 22a reproduce bien el plano ( a, b ) de la estructura cristalina mostrada en la figura 21a, con los anillos claramente visibles formados por icosaedros I1 e I2 y centrados por el "tubo". La figura 22b demuestra que ScB 17 C 0.25 no tiene carácter estratificado, sino que su dirección del eje c está formada por la estructura similar a un anillo y las estructuras tubulares. [47]

Sc 0.83–x B 10.0–y C 0.17+y Si 0.083–z ( x = 0.030, y = 0.36 y z = 0.026) tiene una estructura cristalina cúbica con grupo espacial F 4 3m (No. 216) y constante reticular a = 2.03085(5) nm. [48] Este compuesto fue identificado inicialmente como ScB 15 C 0.8 (fase I en el diagrama de fases Sc-BC de la figura 17). Se añadió una pequeña cantidad de Si en el crecimiento del cristal de la zona flotante y, por lo tanto, esta fase es un compuesto cuaternario. Su rara estructura cúbica tiene 26 sitios en la celda unitaria: tres sitios Sc, dos sitios Si, un sitio C y 20 sitios B; 4 de los 20 sitios B son sitios de ocupación mixta de boro-carbono. Las coordenadas atómicas, las ocupaciones del sitio y los factores de desplazamiento isotrópico se enumeran en la tabla VIII . [48]
En la celda unitaria, hay tres icosaedros independientes, I1, I2 e I3, y un poliedro B 10 que están formados por los sitios B1–B4, B5–B8, B9–B13 y B14–B17, respectivamente. [nota 1] El poliedro B 10 no se había observado previamente y se muestra en la figura 23. El icosaedro I2 tiene un sitio de ocupación mixta de boro-carbono B,C6 cuya ocupación es B/C=0,58/0,42. Los 3 sitios restantes de ocupación mixta de boro-carbono son sitios puente; los sitios C y Si también son sitios puente. [48]
Más de 1000 átomos están disponibles en la celda unitaria, que está formada por grandes unidades estructurales como dos supertetraedros T(1) y T(2) y un superoctaedro O(1). Como se muestra en la figura 24a, T(1) consta de 4 icosaedros I(1) que no tienen enlaces directos pero están unidos por cuatro átomos B y C20. Estos átomos también forman un tetraedro centrado por los sitios Si2. El supertetraedro T(2) que consta de 4 icosaedros I(2) es el mismo que se muestra en la figura 18b; sus sitios de ocupación mixta B y C6 se unen directamente entre sí. El superoctaedro O(1) consta de 6 icosaedros I(3) y sitios de puente B, C18, C1 y Si1; aquí Si1 y C1 exhiben una disposición tetraédrica en el centro de O(1). Los poliedros B 10 también se organizan octaédricamente, sin el átomo central, como se muestra en la figura 24c donde los átomos B y C19 unen los poliedros B 10 para formar el supercúmulo octaédrico de los poliedros B 10. [48]

Usando estos grandes poliedros, la estructura cristalina de Sc 0.83–x B 10.0–y C 0.17+y Si 0.083–z puede describirse como se muestra en la figura 25. Debido a la simetría del cristal, la coordinación tetraédrica entre estas unidades de superestructura es nuevamente un factor clave. El supertetraedro T(1) se encuentra en el centro del cuerpo y en el centro del borde de la celda unitaria. Los superoctaedros O(1) se ubican en el centro del cuerpo (0.25, 0.25, 0.25) del cuarto de la celda unitaria. Se coordinan tetraédricamente alrededor de T(1) formando un tetraedro gigante. Los supertetraedros T(2) se ubican en las posiciones relacionadas con la simetría (0.25, 0.25, 0.75); también forman un tetraedro gigante que rodea a T(1). Los bordes de ambos tetraedros gigantes se cruzan ortogonalmente entre sí en sus centros; En esos centros de aristas, cada poliedro B 10 une todos los grupos de superestructuras T(1), T(2) y O(1). El superoctaedro formado por poliedros B 10 se encuentra en cada centro de cara cúbica. [48]
Los átomos de escandio residen en los huecos de la estructura del boro. Cuatro átomos de Sc1 forman una disposición tetraédrica dentro del superoctaedro basado en el poliedro B 10. Los átomos de Sc2 se ubican entre el superoctaedro basado en el poliedro B 10 y el superoctaedro O(1). Tres átomos de Sc3 forman un triángulo y están rodeados por tres poliedros B 10 , un supertetraedro T(1) y un superoctaedro O(1). [48]
ScB 14–x C x tiene una estructura cristalina ortorrómbica con grupo espacial Imma (No. 74) y constantes reticulares de a = 0,56829(2), b = 0,80375(3) y c = 1,00488(4) nm. La estructura cristalina de ScB 14–x C x es isotípica a la de MgAlB 14 donde Sc ocupa el sitio de Mg, el sitio de Al está vacío y el sitio del puente de boro es un sitio de ocupación mixta B/C con la ocupación de B/C = 0,45/0,55. [49] La ocupación del sitio Sc en monocristales cultivados con fundente es 0,964(4), es decir, casi 1. El crecimiento por reacción en polvo en estado sólido resultó en una menor ocupación del sitio Sc y en la composición química resultante ScB 15 C 1,6 . [40] La distancia de enlace BC de 0,1796(3) nm entre los sitios del puente B/C es bastante larga en comparación con la de un enlace covalente BC ordinario (0,15-0,16 nm), lo que sugiere un enlace débil entre los sitios del puente B/C.
Sc 4.5–x B 57–y+z C 3.5–z (x = 0.27, y = 1.1, z = 0.2) tiene una estructura cristalina ortorrómbica con grupo espacial Pbam (No. 55) y constantes reticulares de a = 1.73040(6), b = 1.60738(6) y c = 1.44829(6) nm. [41] Esta fase se indica como ScB 12.5 C 0.8 (fase IV) en el diagrama de fases de la figura 17. Esta rara estructura ortorrómbica tiene 78 posiciones atómicas en la celda unitaria: siete sitios Sc parcialmente ocupados, cuatro sitios C, 66 sitios B incluyendo tres sitios parcialmente ocupados y un sitio de ocupación mixta B/C. Las coordenadas atómicas, las ocupaciones de los sitios y los factores de desplazamiento isotrópico se enumeran en la tabla IX .
En la celda unitaria hay más de 500 átomos disponibles. En la estructura cristalina hay seis icosaedros estructuralmente independientes I1–I6, que se construyen a partir de los sitios B1–B12, B13–B24, B25–B32, B33–B40, B41–B44 y B45–B56, respectivamente; los sitios B57–B62 forman un poliedro B8 . La estructura cristalina Sc 4.5–x B 57–y+z C 3.5–z es estratificada, como se muestra en la figura 26. Esta estructura se ha descrito en términos de dos tipos de capas de icosaedro de boro, L1 y L2. L1 consta de los icosaedros I3, I4 e I5 y el "dímero" C65, y L2 consta de los icosaedros I2 e I6. I1 está intercalado entre L1 y L2 y el poliedro B8 está intercalado entre L2.
Una descripción alternativa se basa en el mismo supericosaedro B 12 (B 12 ) 12 que en la estructura YB 66. En la estructura cristalina YB 66 , los supericosaedros forman un marco tridimensional de boro como se muestra en la figura 5. En este marco, los supericosaedros vecinos están rotados 90° entre sí. Por el contrario, en Sc 4.5–x B 57–y+z C 3.5–z los supericosaedros forman una red bidimensional donde la relación de rotación de 90° se rompe debido a la simetría ortorrómbica. Las proyecciones planares de la conexión del supericosaedro en Sc 4.5–x B 57–y+z C 3.5–z y YB 66 se muestran en las figuras 27a y b, respectivamente. En la estructura cristalina YB 66 , las conexiones supericosaédricas bidimensionales vecinas están desfasadas con respecto a la relación rotacional del supericosaedro. Esto permite el apilamiento tridimensional de la conexión supericosaédrica bidimensional manteniendo la simetría cúbica.
El cúmulo de boro B 80 ocupa el gran espacio entre cuatro supericosaedros, como se describe en la sección REB 66. Por otro lado, las redes de supericosaedros bidimensionales en la estructura cristalina Sc 4.5–x B 57–y+z C 3.5–z se apilan en fase a lo largo del eje z . En lugar del cúmulo B 80 , un par de icosaedros I2 llena el espacio abierto y permanece dentro de la red de supericosaedros, como se muestra en la figura 28, donde el icosaedro I2 está coloreado en amarillo.
Todos los átomos de Sc, excepto Sc3, residen en grandes espacios entre las redes supericosaédricas, y el átomo de Sc3 ocupa un vacío en la red como se muestra en la figura 26. Debido al pequeño tamaño del átomo de Sc, las ocupaciones de los sitios Sc1–Sc5 superan el 95%, y las de los sitios Sc6 y Sc7 son aproximadamente del 90% y el 61%, respectivamente (véase la tabla IX ).

Sc 3.67–x B 41.4–y–z C 0.67+z Si 0.33–w (x = 0.52, y = 1.42, z = 1.17 y w = 0.02) tiene una estructura cristalina hexagonal con grupo espacial P 6 m2 (No. 187) y constantes reticulares a = b = 1.43055(8) y c = 2.37477(13) nm. [50] Se obtuvieron monocristales de este compuesto como una fase de intercrecimiento en un monocristal con zona flotante de Sc 0.83–x B 10.0–y C 0.17+y Si 0.083–z . Esta fase no se describe en el diagrama de fases de la figura 17 porque es un compuesto cuaternario. Su estructura hexagonal es poco común y tiene 79 posiciones atómicas en la celda unitaria: ocho sitios Sc parcialmente ocupados, 62 sitios B, dos sitios C, dos sitios Si y seis sitios B/C. Seis sitios B y uno de los dos sitios Si tienen ocupaciones parciales. Las coordenadas atómicas asociadas, las ocupaciones de los sitios y los factores de desplazamiento isotrópico se enumeran en la tabla X. [50]
Hay siete icosaedros estructuralmente independientes I1–I7 que están formados por los sitios B1–B8, B9–B12, B13–B20, B/C21–B24, B/C25–B29, B30–B37 y B/C38–B42, respectivamente; los sitios B43–B46 forman el poliedro B 9 y los sitios B47–B53 construyen el poliedro B 10. Los sitios B54–B59 forman el poliedro B 16 de forma irregular en el que solo están disponibles 10,7 átomos de boro porque la mayoría de los sitios están demasiado cerca unos de otros para estar ocupados simultáneamente. Diez sitios de puente C60–B69 interconectan unidades de poliedro u otros sitios de puente para formar una estructura de marco de boro 3D. Una descripción de la estructura cristalina utiliza tres unidades tipo pilares que se extienden a lo largo del eje c [50] que, sin embargo, dan como resultado superposiciones no deseadas entre esas tres unidades tipo pilares. Una alternativa es definir dos unidades de estructura tipo pilares. La Figura 29 muestra la estructura del marco de boro de Sc 3.67–x B 41.4–y–z C 0.67+z Si 0.33–w vista a lo largo del eje c , donde las unidades tipo pilares P1 y P2 están coloreadas en verde oscuro y verde claro respectivamente y están unidas por icosaedros amarillos I4 e I7.
Estas unidades de tipo pilar P1 y P2 se muestran en las figuras 30a y b, respectivamente. P1 consta de icosaedros I1 e I3, un poliedro B 16 de forma irregular y otros átomos en sitios puente donde se pueden ver dos supericosaedros por encima y por debajo del poliedro B 16. Cada supericosaedro está formado por tres icosaedros I1 y tres icosaedros I3 y es el mismo que el supericosaedro O(1) que se muestra en la figura 24a. La unidad P2 consta de icosaedros I2, I5 e I6, poliedro B 10 y otros átomos en sitios puente. Ocho sitios Sc con ocupaciones entre 0,49 (Sc8) y 0,98 (Sc1) repartidos por el marco de boro. [50]
Como se ha descrito anteriormente, esta fase hexagonal se origina a partir de una fase cúbica, por lo que se puede esperar un elemento estructural similar en estas fases. Existe una relación obvia entre el plano hexagonal ab y el plano cúbico (111). Las figuras 31a y b muestran los planos hexagonal (001) y cúbico (111), respectivamente. Ambas estructuras de red son casi iguales, lo que permite el crecimiento conjunto de la fase hexagonal en la fase cúbica. [50]
La diversidad de las estructuras cristalinas de los boruros de tierras raras da como resultado propiedades físicas inusuales y aplicaciones potenciales en la generación de energía termoeléctrica . [51] La conductividad térmica de los compuestos basados en icosaedros de boro es baja debido a su compleja estructura cristalina; esta propiedad es favorecida para los materiales termoeléctricos. Por otro lado, estos compuestos exhiben una conductividad eléctrica de tipo p muy baja (tipo de salto de rango variable ) . Aumentar la conductividad es una cuestión clave para las aplicaciones termoeléctricas de estos boruros.
El YB 66 se utiliza como monocromador de rayos X suaves para dispersar la radiación de sincrotrón de 1–2 keV en algunas instalaciones de radiación de sincrotrón. [52] [53] A diferencia de las aplicaciones termoeléctricas, es deseable una alta conductividad térmica para los monocromadores de radiación de sincrotrón. El YB 66 exhibe una conductividad térmica baja, similar a la de un material amorfo. Sin embargo, el dopaje con metales de transición aumenta la conductividad térmica dos veces en YNb 0.3 B 62 en comparación con el YB 66 sin dopar . [24]
{{cite journal}}: CS1 maint: nombres múltiples: lista de autores ( enlace ) CS1 maint: nombres numéricos: lista de autores ( enlace )