La epibatidina es un alcaloide clorado secretado por la rana ecuatoriana Epipedobates anthonyi y las ranas venenosas del género Ameerega . [1] Fue descubierta por John W. Daly en 1974, pero su estructura no se dilucidó por completo hasta 1992. Si la epibatidina se produce de forma natural sigue siendo controvertida debido a las dificultades para identificar de forma concluyente el compuesto a partir de las muestras limitadas recogidas por Daly. En el momento en que se utilizó la espectrometría de alta resolución en 1991, quedaba menos de un miligramo de extracto de las muestras de Daly, lo que generó inquietudes sobre una posible contaminación. Las muestras de otros lotes de la misma especie de rana no produjeron epibatidina. [2]
La epibatidina es tóxica. Su toxicidad se debe a su capacidad de interactuar con los receptores nicotínicos y muscarínicos de acetilcolina . Estos receptores están involucrados en la transmisión de sensaciones dolorosas y en el movimiento, entre otras funciones. La epibatidina luego causa entumecimiento y, eventualmente, parálisis. Las dosis son letales cuando la parálisis causa paro respiratorio. Originalmente, se pensó que la epibatidina podría ser útil como fármaco. Sin embargo, debido a su índice terapéutico inaceptable , ya no se investiga para posibles usos terapéuticos. [3]
La epibatidina fue descubierta por John W. Daly en 1974. Fue aislada de la piel de ranas Epipedobates anthonyi recolectadas por Daly y su colega, Charles Myers. Entre 1974 y 1979, Daly y Myers recolectaron las pieles de casi 3000 ranas de varios sitios en Ecuador, después de descubrir que una pequeña inyección de una preparación de su piel causó efectos analgésicos (para aliviar el dolor) en ratones que se parecían a los de un opioide . [2] A pesar de que su nombre común - rana flecha venenosa de Anthony - sugiere que era utilizada por los nativos cuando cazaban, [4] un artículo escrito por Daly en 2000 afirmó que no había folclore local ni medicina popular en torno a las ranas y que los lugareños las consideraban en gran medida poco importantes. [5]

La estructura de la epibatidina se dilucidó en 1992, un esfuerzo obstaculizado por la obtención del estatus de protección de la UICN para E. anthonyi en 1984. [5] Además, estas ranas no producen la toxina cuando se crían y se crían en cautiverio, porque no sintetizan epibatidina por sí mismas. Al igual que otras ranas venenosas dardo, la obtienen a través de su dieta y luego la secuestran en su piel. Las fuentes dietéticas probables son escarabajos, hormigas, ácaros y moscas. [6] Daly y Charles notaron que la epibatidina se producía a partir de su dieta debido a su viaje de regreso a Ecuador en 1976, cuando descubrieron que en un sitio, ninguna de las ranas presentes producía alcaloides, como la epibatidina; descubrieron que solo las ranas en ciertos sitios con los medios dietéticos permitían que estas ranas produjeran epibatidina. [7] Superadas las dificultades, finalmente se determinó la estructura y la primera síntesis de epibatidina se completó en 1993. Desde entonces se han desarrollado muchos otros métodos de síntesis. [5]
Debido a su efecto analgésico, el uso de la epibatidina como fármaco generó un gran interés, ya que se descubrió que no era un opioide. [2] Esto significaba que podría utilizarse potencialmente sin temor a que se produjera una adicción. Sin embargo, pronto se descubrió que no podía utilizarse en humanos porque la dosis que provocaba síntomas tóxicos era demasiado baja para que fuera segura. [8]
Se han ideado varias rutas de síntesis total debido a la relativa escasez de epibatidina en la naturaleza. [9]
Tras el descubrimiento de la estructura de la epibatidina, se han ideado más de cincuenta formas de sintetizarla en el laboratorio. En el primer ejemplo del que se tiene constancia, un procedimiento de nueve pasos produce la sustancia en forma de racemato (en cambio, el compuesto natural es el enantiómero (+); el enantiómero (−) no se produce de forma natural). Más tarde se determinó que los enantiómeros (+) y (-) tenían efectos analgésicos y tóxicos equivalentes. El proceso ha demostrado ser bastante productivo, con un rendimiento de alrededor del 40 %. [10] [11] [12]
A continuación se describe una síntesis enantioselectiva informada por EJ Corey a partir de cloronicotinaldehído:
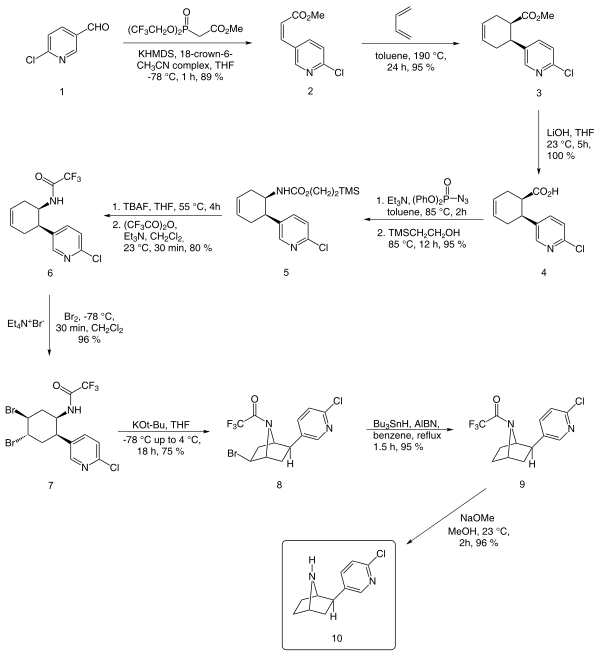
Además del método de Corey, otros métodos notables incluyen los de Broka, [13] Huang y Shen, [14] y Clayton y Regan. [11]
Se han intentado varios enfoques para descubrir análogos estructurales de la epibatidina que mantengan los efectos analgésicos, pero sin la toxicidad. [15] Por ejemplo, Abbott Laboratories ha producido derivados de la epibatidina, incluido el ABT-594 . [16] El ABT-594 conserva las propiedades analgésicas al tiempo que evita la parálisis al seguir uniéndose a los receptores que controlan la percepción del dolor y tener una baja afinidad por los receptores nicotínicos de acetilcolina de tipo muscular (nAChR), lo que reduce su efecto paralizante. [17] Otros análogos de la epibatidina incluyen el ABT-418 , la epiboxidina y sus derivados. [15] [18] [19] [20] [21] En 1999 se publicó una síntesis de epibatidina, que utiliza una hidroxilación microbiana de un carbón no activado en un 7-azanorbornano. [22]
La epibatidina es una piridina piperidina con una estructura similar a la de la nicotina . [23] Es una sustancia oleosa higroscópica que es una base .
La epibatidina tiene dos mecanismos de acción: puede unirse a los receptores nicotínicos de acetilcolina (nAChR) o a los receptores muscarínicos de acetilcolina (mAChR). En concreto, se cree que la propiedad analgésica de la epibatidina se produce por su unión al subtipo α4/β2 de receptores nicotínicos. La epibatidina también se une al subtipo α3/β4 y, en mucha menor medida, a los receptores α7 (afinidad 300 veces menor que para los α4/β2 ) [24]. El orden de afinidad de los receptores nicotínicos musculares es αε > αγ > αδ. [25]
Los receptores nicotínicos de acetilcolina se encuentran en las membranas postsinápticas de las células nerviosas. Estos receptores son un ejemplo de canales controlados por iones donde la unión de un ligando provoca un cambio conformacional que permite que los iones crucen la membrana hacia la célula. [26] Propaga la neurotransmisión en el sistema nervioso central y periférico . Cuando los neurotransmisores se unen a estos receptores, los canales iónicos se abren, permitiendo que los iones Na + y Ca 2+ se muevan a través de la membrana. Esto despolariza la membrana postsináptica, induciendo un potencial de acción que propaga la señal. Esta señal finalmente inducirá la liberación de dopamina y norepinefrina , lo que resulta en un efecto antinociceptivo en el organismo. El neurotransmisor habitual para nAChR es la acetilcolina. Sin embargo, otras sustancias (como la epibatidina y la nicotina ) también pueden unirse al receptor e inducir una respuesta similar, si no idéntica. La epibatidina tiene una afinidad extremadamente alta por los nAChR, dependiendo del subtipo de receptor, desde 0,05 nM en el subtipo α4β2 hasta 22 nM en el subtipo α7. La afinidad , así como la eficacia (y, por lo tanto, también la potencia ), son mucho mayores que en el caso de la nicotina. [10]
La propiedad paralizante de la epibatidina tiene lugar después de su unión a los receptores nicotínicos de tipo muscular .
Las dosis bajas de epibatidina solo afectarán a los nAChR, debido a una mayor afinidad por los nAChR que por los mAChR. Sin embargo, las dosis más altas harán que la epibatidina se una a los mAChR.
Tanto el enantiómero (+) como el enantiómero (-) de la epibatidina son biológicamente activos y ambos tienen afinidades de unión similares con los nAChR [10] . Sólo el enantiómero (+) no induce tolerancia. Si bien esto puede ser una posible ventaja terapéutica sobre la morfina, la epibatidina no ha entrado en ensayos clínicos porque incluso dosis muy pequeñas son letales para los roedores. [27]
La epibatidina tiene varias consecuencias tóxicas. Los efectos probados empíricamente incluyen descarga del nervio simpático esplácnico y aumento de la presión arterial. [23] Los efectos de descarga nerviosa pueden causar antinocicepción parcialmente mediada por el agonismo de los receptores nicotínicos centrales de acetilcolina en dosis bajas de epibatidina; 5 μg/kg. [28] Sin embargo, en dosis más altas, la epibatidina causará parálisis y pérdida de conciencia, coma y eventualmente la muerte. La dosis letal media (LD50 ) de epibatidina se encuentra entre 1,46 μg/kg y 13,98 μg/kg. [29] Esto hace que la epibatidina sea algo más tóxica que la dioxina (con una LD50 media de 22,8 μg/kg). [ cita requerida ] Debido a la pequeña diferencia entre su concentración tóxica y la concentración antinociceptiva, sus usos terapéuticos son muy limitados.
En estudios realizados con ratones, la administración de dosis superiores a 5 μg/kg de epibatidina provocó un efecto paralizante dosis-dependiente en el organismo. Con dosis superiores a 5 μg/kg, los síntomas incluyeron hipertensión (aumento de la presión arterial), parálisis en el sistema respiratorio , convulsiones y, finalmente, la muerte. Sin embargo, los síntomas cambian drásticamente cuando se administran dosis más bajas. Los ratones se volvieron resistentes al dolor y al calor sin ninguno de los efectos negativos de las dosis más altas.
La epibatidina ingresa al cuerpo con mayor eficacia a través de una inyección. [30] Los estudios in vitro parecen sugerir que la epibatidina apenas se metaboliza, o no se metaboliza, en el cuerpo humano. [31]
Además, actualmente hay poca información sobre la vía de eliminación del organismo. La concentración máxima en el cerebro se alcanza aproximadamente 30 minutos después de entrar en el organismo. [10]
La epibatidina tiene una alta potencia analgésica, como se mencionó anteriormente. Los estudios muestran que tiene una potencia al menos 200 veces mayor que la de la morfina . [10] Como el compuesto no era adictivo ni causaba habituación , [ cita requerida ] , inicialmente se pensó que era muy prometedor para reemplazar a la morfina como analgésico. Sin embargo, la concentración terapéutica está muy cerca de la concentración tóxica. Esto significa que incluso a una dosis terapéutica (5 μg/kg [28] ), algo de epibatidina podría unirse a los receptores muscarínicos de acetilcolina y causar efectos adversos, como hipertensión , bradicardia y paresia muscular . [23]
En comparación con el estándar de oro en el tratamiento del dolor, la morfina , la epibatidina necesitó solo 2,5 μg/kg (11,98 nmol/kg) para iniciar un efecto analgésico, mientras que el mismo efecto requirió aproximadamente 10 mg/kg (35,05 μmol/kg) de morfina (aproximadamente 2900 veces la eficacia). Actualmente, solo se han realizado investigaciones rudimentarias sobre los efectos de la epibatidina; el fármaco se ha administrado solo a roedores para su análisis en este momento. [12]
El antídoto de la epibatidina es la mecamilamina , [32] un antagonista del receptor nicotínico de acetilcolina que no es selectivo ni competitivo. [33] Se observó que tanto los enantiómeros (+) como los (-) de la mecamilamina eran eficaces y ambos tienen la misma afinidad por los receptores nicotínicos de acetilcolina. [34]