
En la ciencia de superficies , la energía superficial (también energía libre interfacial o energía libre superficial ) cuantifica la ruptura de los enlaces intermoleculares que se produce cuando se crea una superficie . En física del estado sólido , las superficies deben ser intrínsecamente menos favorables energéticamente que la mayor parte del material (los átomos en la superficie tienen más energía en comparación con los átomos en la mayor parte), de lo contrario habría una fuerza impulsora para crear superficies, eliminando la mayor parte del material (ver sublimación ). Por lo tanto, la energía superficial puede definirse como el exceso de energía en la superficie de un material en comparación con el volumen total, o es el trabajo necesario para construir un área de una superficie particular. Otra forma de ver la energía superficial es relacionarla con el trabajo requerido para cortar una muestra en masa, creando dos superficies. Existe un "exceso de energía" como resultado de la unión ahora incompleta y no realizada entre las dos superficies creadas.
Cortar un cuerpo sólido en pedazos rompe sus enlaces y aumenta el área de superficie y, por lo tanto, aumenta la energía superficial. Si el corte se realiza de forma reversible , entonces la conservación de energía significa que la energía consumida por el proceso de corte será igual a la energía inherente a las dos nuevas superficies creadas. La energía superficial unitaria de un material sería, por tanto, la mitad de su energía de cohesión , en igualdad de condiciones; en la práctica, esto sólo es válido para una superficie recién preparada al vacío . Las superficies a menudo cambian su forma alejándose del modelo simple de " enlace escindido " que acabamos de mencionar. Se ha descubierto que son regiones altamente dinámicas, que se reorganizan o reaccionan fácilmente , de modo que la energía a menudo se reduce mediante procesos como la pasivación o la adsorción .
La forma más común de medir la energía superficial es mediante experimentos de ángulos de contacto . [1] En este método, el ángulo de contacto de la superficie se mide con varios líquidos, normalmente agua y diyodometano . En base a los resultados del ángulo de contacto y conociendo la tensión superficial de los líquidos, se puede calcular la energía superficial. En la práctica, este análisis se realiza automáticamente mediante un medidor de ángulos de contacto. [2]
Existen varios modelos diferentes para calcular la energía superficial basándose en las lecturas del ángulo de contacto. [3] El método más utilizado es OWRK, que requiere el uso de dos líquidos sonda y como resultado proporciona la energía superficial total y la divide en componentes polares y dispersivos.
El método del ángulo de contacto es el método estándar de medición de energía superficial debido a su simplicidad, aplicabilidad a una amplia gama de superficies y rapidez. La medición se puede automatizar completamente y está estandarizada. [4]
En general, a medida que aumenta la energía superficial, el ángulo de contacto disminuye porque la superficie "agarra" una mayor cantidad de líquido. Por el contrario, a medida que disminuye la energía superficial, el ángulo de contacto aumenta, porque la superficie no quiere interactuar con el líquido.
La energía superficial de un líquido se puede medir estirando una membrana líquida (lo que aumenta el área superficial y, por tanto, la energía superficial). En ese caso, para aumentar el área superficial de una masa de líquido en una cantidad, δA , se necesita una cantidad de trabajo , γ δA (donde γ es la densidad de energía superficial del líquido). Sin embargo, dicho método no se puede utilizar para medir la energía superficial de un sólido porque el estiramiento de una membrana sólida induce energía elástica en la masa además de aumentar la energía superficial.
La energía superficial de un sólido suele medirse a altas temperaturas. A tales temperaturas el sólido se arrastra y aunque el área de la superficie cambia, el volumen permanece aproximadamente constante. Si γ es la densidad de energía superficial de una varilla cilíndrica de radio r y longitud l a alta temperatura y una tensión uniaxial constante P , entonces en el equilibrio, la variación de la energía libre total de Helmholtz desaparece y tenemos
donde F es la energía libre de Helmholtz y A es el área de superficie de la varilla:
Además, dado que el volumen ( V ) de la varilla permanece constante, la variación ( δV ) del volumen es cero, es decir,
Por lo tanto, la densidad de energía superficial se puede expresar como
La densidad de energía superficial del sólido se puede calcular midiendo P , r y l en equilibrio.
Este método es válido sólo si el sólido es isotrópico , lo que significa que la energía superficial es la misma para todas las orientaciones cristalográficas . Si bien esto sólo es estrictamente cierto para sólidos amorfos ( vidrio ) y líquidos, la isotropía es una buena aproximación para muchos otros materiales. En particular, si la muestra es poligranular (la mayoría de los metales) o está hecha mediante sinterización de polvo (la mayoría de las cerámicas), esta es una buena aproximación.
En el caso de materiales monocristalinos, como las piedras preciosas naturales , la anisotropía en la energía superficial conduce al facetado . La forma del cristal (asumiendo condiciones de crecimiento en equilibrio ) está relacionada con la energía superficial mediante la construcción de Wulff . Por tanto, la energía superficial de las facetas se puede encontrar dentro de una constante de escala midiendo los tamaños relativos de las facetas.
En la deformación de sólidos, la energía superficial puede tratarse como la "energía necesaria para crear una unidad de superficie" y es función de la diferencia entre las energías totales del sistema antes y después de la deformación:
El cálculo de la energía superficial a partir de los primeros principios (por ejemplo, la teoría funcional de la densidad ) es un enfoque alternativo a la medición. La energía superficial se estima a partir de las siguientes variables: ancho de la banda d, número de electrones d de valencia y número de coordinación de los átomos en la superficie y en la mayor parte del sólido. [5] [ página necesaria ]
En la teoría del funcional de la densidad , la energía superficial se puede calcular a partir de la siguiente expresión:
dónde
Para una losa, tenemos dos superficies y son del mismo tipo, lo cual se refleja en el número 2 en el denominador. Para garantizar esto, debemos crear la losa con cuidado para asegurarnos de que las superficies superior e inferior sean del mismo tipo.
La fuerza de los contactos adhesivos está determinada por el trabajo de adhesión, que también se denomina energía superficial relativa de dos cuerpos en contacto. [6] [ página necesaria ] La energía superficial relativa se puede determinar separando cuerpos de forma bien definida hechos de un material del sustrato hecho del segundo material. [7] Por ejemplo, la energía superficial relativa de la interfaz " vidrio acrílico – gelatina " es igual a 0,03 N/m. En el vídeo se puede ver la configuración experimental para medir la energía superficial relativa y su función. [8]
Para estimar la energía superficial de un material puro y uniforme, se puede modelar una región individual del material como un cubo. Para mover un cubo desde la masa de un material hasta la superficie, se requiere energía. Este coste energético se incorpora a la energía superficial del material, que se cuantifica mediante:

donde z σ y z β son números de coordinación correspondientes a la superficie y a las regiones masivas del material, y son iguales a 5 y 6, respectivamente; a 0 es el área de superficie de una molécula individual y W AA es la energía intermolecular por pares.
El área de superficie se puede determinar elevando al cuadrado la raíz cúbica del volumen de la molécula:
Aquí, M̄ corresponde a la masa molar de la molécula, ρ corresponde a la densidad y N A es la constante de Avogadro .
Para determinar la energía intermolecular por pares, se deben romper todas las fuerzas intermoleculares en el material. Esto permite una investigación exhaustiva de las interacciones que ocurren para moléculas individuales. Durante la sublimación de una sustancia, las fuerzas intermoleculares entre las moléculas se rompen, lo que da como resultado un cambio en el material de sólido a gas. Por esta razón, considerar la entalpía de sublimación puede resultar útil para determinar la energía intermolecular por pares. La entalpía de sublimación se puede calcular mediante la siguiente ecuación:
Utilizando valores empíricamente tabulados para la entalpía de sublimación, es posible determinar la energía intermolecular por pares. La incorporación de este valor a la ecuación de la energía superficial permite estimar la energía superficial.
La siguiente ecuación se puede utilizar como una estimación razonable de la energía superficial:
La presencia de una interfaz influye generalmente en todos los parámetros termodinámicos de un sistema. Hay dos modelos que se utilizan comúnmente para demostrar fenómenos interfaciales: el modelo de interfaz ideal de Gibbs y el modelo de Guggenheim. Para demostrar la termodinámica de un sistema interfacial utilizando el modelo de Gibbs, el sistema se puede dividir en tres partes: dos líquidos inmiscibles con volúmenes V α y V β y una capa límite infinitamente delgada conocida como plano divisorio de Gibbs ( σ ) que separa estos dos volúmenes.


El volumen total del sistema es:
Todas las cantidades extensivas del sistema se pueden escribir como una suma de tres componentes: fase masiva α , fase masiva β y la interfaz σ . Algunos ejemplos incluyen la energía interna U , el número de moléculas de la i -ésima sustancia n i y la entropía S.
Si bien estas cantidades pueden variar entre cada componente, la suma dentro del sistema permanece constante. En la interfaz, estos valores pueden desviarse de los presentes dentro de las fases masivas. La concentración de moléculas presentes en la interfaz se puede definir como:
donde c iα y c iβ representan la concentración de sustancia i en la fase masiva α y β , respectivamente.
Es beneficioso definir un nuevo término exceso interfacial Γ i que nos permita describir el número de moléculas por unidad de área:
La energía superficial entra en juego en los fenómenos de humectación. Para examinar esto, considere una gota de líquido sobre un sustrato sólido. Si la energía superficial del sustrato cambia al agregar la gota, se dice que el sustrato se está humedeciendo . El parámetro de dispersión se puede utilizar para determinar esto matemáticamente:
donde S es el parámetro de dispersión, γ s la energía superficial del sustrato, γ l la energía superficial del líquido y γ s-l la energía interfacial entre el sustrato y el líquido.
Si S < 0 , el líquido moja parcialmente el sustrato. Si S > 0 , el líquido moja completamente el sustrato. [9]
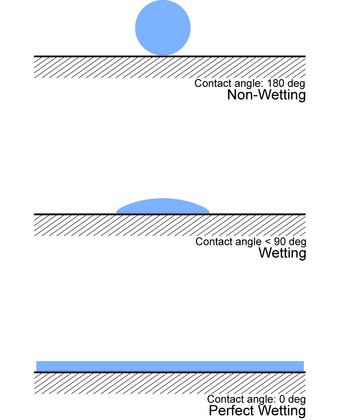
Una forma de determinar experimentalmente la humectación es observar el ángulo de contacto ( θ ), que es el ángulo que conecta la interfaz sólido-líquido y la interfaz líquido-gas (como en la figura).
La ecuación de Young relaciona el ángulo de contacto con la energía interfacial:
donde γ s-g es la energía interfacial entre las fases sólida y gaseosa, γ s-l la energía interfacial entre el sustrato y el líquido, γ l-g es la energía interfacial entre las fases líquida y gaseosa, y θ es el ángulo de contacto entre el sólido y el líquido y la interfaz líquido-gas. [11]
La energía del componente mayoritario de un sustrato sólido está determinada por los tipos de interacciones que mantienen unido el sustrato. Los sustratos de alta energía se mantienen unidos mediante enlaces , mientras que los sustratos de baja energía se mantienen unidos mediante fuerzas . Los enlaces covalentes , iónicos y metálicos son mucho más fuertes que fuerzas como las de van der Waals y los enlaces de hidrógeno . Los sustratos de alta energía se humedecen más fácilmente que los sustratos de baja energía. [12] Además, se producirá una humectación más completa si el sustrato tiene una energía superficial mucho mayor que el líquido. [13]
Los protocolos de modificación de superficies más utilizados son la activación por plasma , el tratamiento químico húmedo, incluidos los injertos, y el recubrimiento de película fina. [14] [15] [16] La imitación de la energía superficial es una técnica que permite fusionar la fabricación del dispositivo y las modificaciones de la superficie, incluido el diseño, en un solo paso de procesamiento utilizando un solo material del dispositivo. [17]
Se pueden utilizar muchas técnicas para mejorar la humectación. Los tratamientos superficiales, como el tratamiento corona , [18] el tratamiento con plasma y el grabado ácido , [19] se pueden utilizar para aumentar la energía superficial del sustrato. También se pueden agregar aditivos al líquido para disminuir su tensión superficial. Esta técnica se emplea a menudo en formulaciones de pinturas para garantizar que se distribuyan uniformemente sobre una superficie. [20]
Como resultado de la tensión superficial inherente a los líquidos, se forman superficies curvas para minimizar el área. Este fenómeno surge del coste energético que supone formar una superficie. Como tal, la energía libre de Gibbs del sistema se minimiza cuando la superficie es curva.

La ecuación de Kelvin se basa en principios termodinámicos y se utiliza para describir los cambios en la presión de vapor causados por líquidos con superficies curvas. La causa de este cambio en la presión de vapor es la presión de Laplace. La presión de vapor de una gota es mayor que la de una superficie plana porque el aumento de la presión de Laplace hace que las moléculas se evaporen más fácilmente. Por el contrario, en los líquidos que rodean una burbuja, la presión con respecto a la parte interior de la burbuja se reduce, dificultando así la evaporación de las moléculas. La ecuación de Kelvin se puede expresar como:
donde PK
0es la presión de vapor de la superficie curva, P 0 es la presión de vapor de la superficie plana, γ es la tensión superficial , V m es el volumen molar del líquido, R es la constante universal de los gases , T es la temperatura (en kelvin ) , y R 1 y R 2 son los principales radios de curvatura de la superficie.
Los pigmentos ofrecen un gran potencial para modificar las propiedades de aplicación de un recubrimiento. Debido a su fino tamaño de partícula y su inherente alta energía superficial, a menudo requieren un tratamiento superficial para mejorar su facilidad de dispersión en un medio líquido. Anteriormente se ha utilizado una amplia variedad de tratamientos superficiales, incluida la adsorción en la superficie de una molécula en presencia de grupos polares, monocapas de polímeros y capas de óxidos inorgánicos en la superficie de pigmentos orgánicos. [21]
Constantemente se crean nuevas superficies a medida que las partículas de pigmento más grandes se descomponen en subpartículas más pequeñas. En consecuencia, estas superficies recién formadas contribuyen a energías superficiales mayores, por lo que las partículas resultantes a menudo se cementan entre sí formando agregados. Debido a que las partículas dispersas en medios líquidos están en constante movimiento térmico o browniano , exhiben una fuerte afinidad por otras partículas de pigmento cercanas a medida que se mueven a través del medio y chocan. [21] Esta atracción natural se atribuye en gran medida a las poderosas fuerzas de van der Waals de corto alcance , como efecto de sus energías superficiales.
El objetivo principal de la dispersión de pigmentos es descomponer los agregados y formar dispersiones estables de partículas de pigmento de tamaño óptimo. Este proceso generalmente implica tres etapas distintas: humectación, desagregación y estabilización. Es deseable una superficie que sea fácil de humedecer cuando se formula un recubrimiento que requiere buena adhesión y apariencia. Esto también minimiza los riesgos de defectos relacionados con la tensión superficial, como arrastre, formación de cráteres y piel de naranja . [22] Este es un requisito esencial para las dispersiones de pigmentos; Para que la humectación sea efectiva, la tensión superficial del vehículo del pigmento debe ser menor que la energía libre superficial del pigmento. [21] Esto permite que el vehículo penetre en los intersticios de los agregados de pigmento, asegurando así una humectación completa. Finalmente, las partículas se someten a una fuerza repulsiva para mantenerlas separadas unas de otras y reducir la probabilidad de floculación .
Las dispersiones pueden estabilizarse mediante dos fenómenos diferentes: repulsión de carga y repulsión estérica o entrópica. [22] En la repulsión de carga, las partículas que poseen las mismas cargas electrostáticas se repelen entre sí. Alternativamente, la repulsión estérica o entrópica es un fenómeno utilizado para describir el efecto repelente cuando capas de material adsorbidas (como moléculas de polímero hinchadas con disolvente) están presentes en la superficie de las partículas de pigmento en dispersión. Sólo ciertas porciones (anclajes) de las moléculas de polímero se adsorben, con sus correspondientes bucles y colas extendiéndose hacia la solución. A medida que las partículas se acercan unas a otras, sus capas adsorbidas se apiñan; esto proporciona una barrera estérica eficaz que previene la floculación . [23] Este efecto de apiñamiento va acompañado de una disminución de la entropía, por lo que el número de conformaciones posibles para las moléculas de polímero se reduce en la capa adsorbida. Como resultado, la energía aumenta y a menudo da lugar a fuerzas repulsivas que ayudan a mantener las partículas separadas entre sí.
