El triacetato de aluminio , formalmente llamado acetato de aluminio , [2] es un compuesto químico con composición Al(CH
3CO
2)
3En condiciones estándar aparece como un sólido blanco soluble en agua [1] que se descompone al calentarlo a alrededor de 200 °C. [3] El triacetato se hidroliza a una mezcla de sales básicas de hidróxido/ acetato , [4] y múltiples especies coexisten en equilibrio químico , particularmente en soluciones acuosas del ion acetato; el nombre acetato de aluminio se usa comúnmente para este sistema mixto.
Tiene aplicaciones terapéuticas por sus propiedades antipicazón, astringentes y antisépticas , [5] y, como preparación de venta libre como la solución de Burow , [6] se utiliza para tratar infecciones de oído . [7] [8] Las preparaciones de solución de Burow se han diluido y modificado con aminoácidos para hacerlas más agradables al paladar para su uso como gárgaras para afecciones como las úlceras aftosas de la boca. [9] En medicina veterinaria , la propiedad de astringencia del triacetato de aluminio se utiliza para tratar la enfermedad de Mortellaro en animales con pezuñas como el ganado. [10]
El triacetato de aluminio se utiliza como agente mordiente con colorantes como la alizarina , [11] tanto solo como en combinación. Junto con el diacetato de aluminio [12] o con el sulfacetato de aluminio [13] se utiliza con algodón , otras fibras de celulosa , [14] y seda . [13] También se ha combinado con acetato ferroso para producir diferentes colores. [15]
De acuerdo con las reglas formales para nombrar compuestos inorgánicos , el nombre para Al(CH
3CO
2)
3es acetato de aluminio, [2] aunque se aceptan nombres más formales como acetato de aluminio(III) y etanoato de aluminio. [4] El uso del prefijo multiplicador "tri" en el nombre triacetato de aluminio, aunque no es técnicamente necesario, se utiliza con regularidad para evitar posibles confusiones con compuestos relacionados con ligandos hidroxo . El diacetato de aluminio básico , formalmente diacetato de hidroxialuminio ( CAS RN 142-03-0), [1] tiene la composición HOAl(CH
3CO
2)
2con un ligando hidroxo en lugar de un ligando acetato, y monoacetato de aluminio dibásico , formalmente acetato de dihidroxialuminio (CAS RN 7360-44-3), tiene composición (HO)
2AlCh
3CO
2con un solo ligando de acetato. Estos tres compuestos son distintos en la fase sólida, pero generalmente se tratan como un grupo y se describen colectivamente como acetato de aluminio en solución, debido a que el triacetato se hidroliza a una mezcla que incluye las otras dos formas. [4] La abreviatura AlAc, junto con variantes como AlAc2+
y AlAc+
2, se utilizan a veces en la disciplina de la geoquímica , [16] aunque son inconsistentes con la práctica estándar en la química convencional . [a]
La fórmula Al(CH
3CO
2)
3indica la presencia de centros de aluminio en el estado de oxidación +3 y grupos acetato en una proporción de 1:3. Las imágenes utilizadas para representar esta sustancia, como las que se muestran a la izquierda, representan dos aproximaciones muy simplificadas de la estructura del estado sólido: la primera es como una sal puramente iónica con un solo catión aluminio (III) (Al 3+ ) rodeado y asociado electrostáticamente con tres aniones acetato ( CH
3CO−
2), pero esto no debe interpretarse como una información sobre la estructura cristalina . Por ejemplo, el cloruro de sodio (NaCl) tiene una estequiometría de catión a anión de 1:1, pero tiene una estructura cúbica en la que cada ion está rodeado octaédricamente por seis iones de carga opuesta. [17]
La otra imagen es una forma molecular con los tres grupos acetato unidos covalentemente al centro metálico en una geometría plana trigonal e interacciones intermoleculares que mantienen unidas a las moléculas entre sí en la estructura cristalina. Es muy probable que la estructura del estado sólido sea más complicada e incluya características tanto covalentes como iónicas y es posible que estén presentes múltiples centros de aluminio y/o grupos acetato puente ; ambos se han descrito en solución de acetato de aluminio [18] y se sabe que el cloruro de aluminio existe como un Al
2Cl
6 dímero . [19]
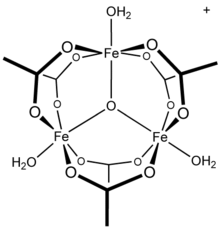
Las investigaciones de RMN del sistema acuoso de aluminio (III) / acetato muestran la presencia de aluminio como un complejo hexaacuoso , [Al(H
2O)
6]3+
, [20] así como especies mononucleares con diferentes sustituciones. Además, las investigaciones demuestran que una especie significativa en fase de solución es un Al
13 tridecámero , [21] una fracción reportada en mecanismos conflictivos de hidrólisis y polimerización de soluciones de aluminio. [22] Se sabe que otros cationes metálicos trivalentes forman especies polinucleares: el acetato de hierro (III) , por ejemplo, forma una estructura trinuclear [23] con un centro oxo triplemente puenteado [24] con el catión [Fe 3 ( μ 3 –O)(OAc) 6 (H 2 O) 3 ] + . [25] El compuesto hidróxido de acetato de cromo , Cr 3 (OH) 2 (OAc) 7 , también se ha descrito como isoestructural. [26] Se conocen compuestos análogos de rutenio (III), vanadio (III), rodio (III) e iridio (III) con estructuras trinucleares. [27] Tanto el acetato de cobre (II) como el acetato de cromo (II) tienen estructuras dihidratadas dinucleares, M 2 (OAc) 4 (H 2 O) 2 , [28] al igual que el acetato de rodio (II) ; [29] cada uno muestra interacciones de enlace metal-metal significativas. [28] [29]
Según el Manual de compuestos inorgánicos del CRC, el triacetato de aluminio es un sólido blanco soluble en agua y generalmente se prepara a partir de cloruro de aluminio o directamente a partir de aluminio calentándolo en una solución de ácido acético con anhídrido acético . [1]
En teoría, todas las sales de aluminio/acetato/hidróxido se pueden preparar a partir de hidróxido de aluminio o aluminato de sodio y ácido acético, pero la formación del triacetato solo ocurre en ausencia de agua. [4] En soluciones, el diacetato es el principal producto formado, y también se produce cuando el cloruro de aluminio se trata con una solución de acetato de sodio en condiciones básicas. [30] Las ecuaciones para estos procesos son:
Se ha patentado un proceso mejorado que utiliza una combinación de cloruro de aluminio y aluminato de sodio con acetato de sodio preparado in situ : [31]
Los mordientes triacetato de aluminio y sulfacetato de aluminio se pueden preparar a partir de sulfato de aluminio , determinándose el producto formado por la cantidad de acetato de plomo (II) utilizada: [13]
Al calentarse, el triacetato de aluminio se descompone por encima de los 200 °C en un proceso similar al del formiato de aluminio . [3] El proceso comienza con la pérdida de anhídrido acético ( Ac
2O ) entre 120 y 140 °C [1] para formar una mezcla de acetatos de óxidos básicos como Al
2O(CH
3CO
2)
4y Al
3O(CH
3CO
2)
7, [30] que finalmente se transforman en Al
2Oh
3( alúmina ), primero como un sólido anhidro amorfo y luego a través de otras fases sólidas ( formas cristalinas γ, δ y θ ) para finalmente convertirse en α- Al polimórfico .
2Oh
3: [3]
El triacetato de aluminio se hidroliza para producir acetatos de hidróxido monobásicos y dibásicos en solución o por higroscopia : [4]
Según el Instituto Nacional del Cáncer , los acetatos de aluminio se utilizan tópicamente en humanos como agentes antisépticos , que también hacen que los tejidos corporales se encojan . [5] Su propiedad de astringencia también se utiliza para tratar la enfermedad de Mortellaro en animales con pezuñas como el ganado. [10] El acetato de aluminio promueve la curación de la piel infectada y también ayuda con la inflamación , la picazón y el escozor. [5] La Administración de Alimentos y Medicamentos lo ha aprobado para su uso para "alivio temporal de irritaciones menores de la piel debido a ... ' hiedra venenosa ', 'roble venenoso', ' zumaque venenoso ', 'picaduras de insectos', ' pie de atleta ' o 'erupciones causadas por jabones, detergentes, cosméticos o joyas'". [32] Para estas aplicaciones, normalmente se utilizan preparaciones de venta libre como la solución de Burow , [6] mientras que las formas diluidas se utilizan como gárgaras para afecciones como las úlceras aftosas de la boca, incluso con aditivos de aminoácidos para mejorar la palatabilidad y el sabor . [9] El uso más común de la solución de Burow es en el tratamiento de infecciones de oído [7] [8] incluyendo la otomicosis , aunque generalmente no es tan eficaz como el clotrimazol en estas infecciones fúngicas. [33] El polvo astringente tópico Domeboro contiene sulfato de aluminio tetradecahidrato , [Al(H
2O)
6]
2(ENTONCES
4)
3•2 horas
2O , y acetato de calcio monohidrato , Ca(CH
3CO
2)
2•H
2O , y forma una solución de acetato de aluminio similar a la solución de Burow cuando se disuelve. [34] Las soluciones de Domeboro en agua tibia se pueden usar en casos de uñas encarnadas , [35] para reducir la irritación y contener cualquier infección que pueda estar presente.

Un mordiente es una sustancia que se utiliza para fijar tintes en telas o secciones de tejido formando un complejo de coordinación con el tinte, que posteriormente se adhiere a la tela o al tejido. [37] Un mordiente a menudo contiene un ion metálico polivalente , comúnmente aluminio o hierro, [38] como es el caso de las mezclas de triacetato de aluminio con sulfacetato de aluminio [13] o con diacetato de aluminio básico. [12] Los mordientes de triacetato de aluminio se han utilizado con algodón , otras fibras a base de celulosa , [14] y seda . [13] También se han combinado con acetato ferroso para producir diferentes colores. [15]

En el caso del colorante alizarina (1,2-dihidroxi antraquinona , H
2Se planteó la hipótesis de que la mordiente implicaba la formación de un dianión de alizarina. Esto formaría un complejo de aluminio de cinco coordenadas, CaAl(OH)Az
2, [39] que puede absorber agua para formar un hidrato con un dianión centrado en aluminio de seis coordenadas, Ca[Al(H
2O)(OH)Az
2]•2 horas
2O . [40] La propuesta se basó en datos espectroscópicos infrarrojos y posteriormente fue cuestionada por un trabajo que sugería una estructura con dos ligandos hidroxilo puente que conectaban un núcleo dinuclear, Az
2Al(μ-OH)
2Al Az4−
2, con dos fracciones de alizarina cada una quelando a cada centro de aluminio. [36] La estructura fue propuesta por Soubayrol et al. basándose en evidencia de espectroscopia de RMN de 27 Al y espectrometría de masas de ionización por electrospray . [41] Informaron que el grado de hidratación dependía de la identidad del contraión, siendo la sal de sodio un tetrahidrato estable con un monohidrato formado a partir de hidróxido de potasio . Estos se podían distinguir en función de sus desplazamientos químicos , lo que sugiere que las aguas se asocian con los centros de aluminio o las fracciones de alizarina, y no se comportan como es típico de las aguas de cristalización . [41]
En 1994 se informó de una estructura relacionada con iones de calcio, y en ella las alizarinas se quelan con los iones de calcio para formar puentes AzCaAz entre los centros de aluminio (que también están unidos por grupos hidroxo) y los centros de aluminio se unen posteriormente a los residuos de fenol desprotonados del colorante; [11] en el modelo de Soubayrol, cada alizarina está asociada a un único catión de aluminio. [41] Al igual que con la estructura del acetato de aluminio en sí, no se han resuelto las formas que adopta en las aplicaciones.
a Este "Ac" no se refiere al elemento actinio . Utilizado de esta manera, la convención en química orgánica es que Ac se refiera al grupo acetilo , cuya forma radical es CH
3CO , [42] y OAc o AcO se utilizarían para el radical acetato , CH
3CO
2, [43] a veces también llamado "acetoxi". El ion acetato sería entonces AcO − , CH
3CO−
2, y el ácido acético sería AcOH o HOAc. Según esta convención, el triacetato de aluminio sería Al(OAc) 3 . Sin embargo, las publicaciones en geoquímica utilizan Ac para referirse al acetato en lugar de acetilo y, por lo tanto, AlAc+
2En geoquímica se escribiría según las convenciones químicas más habituales como [Al(OAc)
2]+
o [Al(CH
3CO
2)
2]+
.