El tolcapona , comercializado bajo la marca Tasmar , es un medicamento utilizado para tratar la enfermedad de Parkinson (EP). Es un inhibidor selectivo, potente y reversible de tipo nitrocatecol de la enzima catecol- O -metiltransferasa (COMT). [5] Ha demostrado una importante toxicidad hepática, lo que ha llevado a la suspensión de las autorizaciones de comercialización en varios países.
El tolcapone parece ser selectivo a nivel periférico , pero aún puede atravesar el cerebro en cantidades significativas y se ha descubierto que también inhibe la COMT a nivel central. [6] [7] En comparación con el entacapona , otro inhibidor de la COMT nitrocatecol, el tolcapone tiene una vida media más larga (2,9 horas frente a 0,8 horas) y puede penetrar mejor en el cerebro, actuando tanto en el sistema nervioso central como en la periferia. [8] Sin embargo, el entacapona es menos tóxico para el hígado.
El tolcapone se utiliza en el tratamiento de la enfermedad de Parkinson como complemento de los medicamentos levodopa/carbidopa o levodopa/ benserazida . La levodopa es un profármaco de la dopamina , que reduce los síntomas del Parkinson; la carbidopa y la benserazida son inhibidores de la L -aminoácido descarboxilasa aromática (AADC). [9]
Sin la administración de tolcapona, los efectos beneficiosos de la levodopa tienden a desaparecer más rápidamente, lo que produce fluctuaciones motoras. [10]
La combinación de tolcapone con inhibidores no selectivos de la monoaminooxidasa como fenelzina o tranilcipromina está contraindicada. [11] El tolcapone también está contraindicado en personas con enfermedades hepáticas o enzimas hepáticas aumentadas . [12]
El tolcapona ha demostrado una importante toxicidad hepática (hepatotoxicidad) [13] que limita la utilidad del fármaco. La entacapona es una alternativa, en gran medida porque tiene un perfil de toxicidad más favorable.
La hepatotoxicidad puede estar relacionada con niveles elevados de transaminasas , pero los estudios han demostrado que existe un riesgo mínimo para aquellos sin afecciones hepáticas preexistentes cuando se controlaban sus niveles de enzimas. No se ha identificado ningún mecanismo claro, pero se ha planteado la hipótesis de que tiene algo que ver con la respiración mitocondrial anormal debido al desacoplamiento de la fosforilación oxidativa . [14]
Otros efectos secundarios se refieren al aumento de la actividad dopaminérgica, incluyendo síntomas digestivos. [12] El tratamiento con tolcapone corre el riesgo de provocar o prolongar la disquinesia ; esto se puede contrarrestar disminuyendo la dosis de levodopa. Esto ocurre porque la administración de tolcapone da lugar a la acumulación del donador de metilo biológico S -adenosil- L -metionina (SAM) en el cuerpo estriado que induce los síntomas de Parkinson. [14]
Los síntomas digestivos incluyen náuseas y diarrea ; otros efectos secundarios dopaminérgicos incluyen hipotensión ortostática , sequedad de boca, sudoración y mareos. El tolcapone causa diarrea más grave que el entacapone; esta fue la razón más común para la interrupción del tratamiento en los estudios. [11] La decoloración de la orina proviene de los metabolitos amarillos del tolcapone que se excretan en la orina y es inofensiva. [12] [14]
Aunque el aumento de los niveles de dopamina es una interacción deseada, el tolcapone teóricamente también puede aumentar los niveles de otros fármacos metabolizados por la COMT, como los inhibidores de la AADC carbidopa y benzerazida, así como metildopa , dobutamina , apomorfina , adrenalina e isoprenalina . En estudios, se observó una ligera interacción con la benzerazida, pero no con la carbidopa. No se han estudiado otras interacciones con este grupo de fármacos. Un tipo relacionado de interacciones teóricas es con fármacos que aumentan las concentraciones de catecolaminas , como los inhibidores de la monoaminooxidasa (MAO) y los inhibidores de la recaptación de noradrenalina ; estos también mostraron solo efectos leves en la práctica. La combinación con inhibidores de la MAO no selectivos puede ser peligrosa. [11] [12]
Debido a su afinidad con la enzima hepática CYP2C9 , también son posibles, aunque poco probables, las interacciones con fármacos metabolizados por esta enzima. No se observó interacción con tolbutamida , un sustrato de 2C9, en los estudios. [12]

El tolcapone se une de forma selectiva y reversible [11] al sitio catalítico de la COMT tanto en la periferia como en el sistema nervioso central (SNC) con mayor afinidad que cualquiera de las tres catecolaminas , incluida la levodopa. [16] De este modo, evita la 3- O -metilación de la levodopa por la COMT en la periferia, lo que produce 3- O -metildopa, un metabolito importante que compite con la levodopa para cruzar la barrera hematoencefálica . Una mayor cantidad de la levodopa administrada llega al SNC. Además, la levodopa que ya ha llegado al SNC, después de convertirse en dopamina, no se degradará tan rápidamente cuando el tolcapone inhiba la actividad de la COMT. Por tanto, el tolcapone mejora la biodisponibilidad y reduce la depuración de la levodopa y, posteriormente, de la dopamina del SNC. [17]

La fuerza de la afinidad de unión del tolcapona, representada por la constante de inhibición Ki ( 2,5 nM), puede considerarse como la constante de disociación para la cinética del complejo enzima-inhibidor. La actividad catalítica máxima denota la eficacia del tolcapona (Vmax = 58,4 pmol/min·mg). [18]
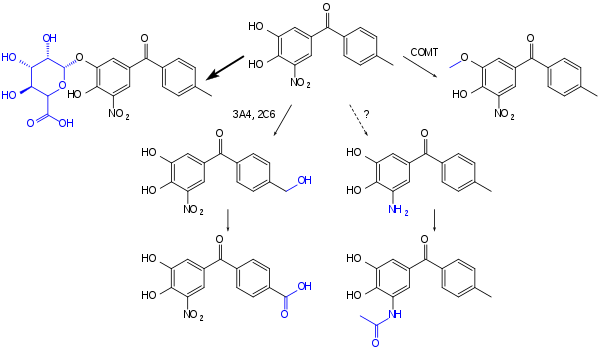
El tolcapone se absorbe rápidamente en el intestino hasta aproximadamente el 85%. Tiene una biodisponibilidad absoluta del 65%, que solo disminuye ligeramente cuando se ingiere con alimentos. La sustancia alcanza las concentraciones plasmáticas más altas después de aproximadamente dos horas. Cuando está en el torrente sanguíneo, está casi completamente unida (>99,9%) a las proteínas plasmáticas , principalmente a la albúmina . El principal paso de inactivación es la glucuronidación ; otros procesos son la metilación por COMT, la hidroxilación por CYP3A4 y CYP2A6 con posterior oxidación a un ácido carboxílico , y posiblemente una vía menor con reducción a una amina con posterior acetilación . [11] [12]
La vida media del tolcapone es de dos a tres horas y el volumen de distribución (Vd ) es de 0,3 L/kg (21 L en una persona de 70 kg de peso medio). [10] El 60% de los metabolitos se excretan por la orina y el 40% por las heces. Sólo el 0,5% del fármaco se excreta en forma inalterada por la orina. [11] [12]
El 99% del tolcapone se encuentra en forma monoaniónica en el cuerpo porque el pH fisiológico es 7,4. El tolcapone penetra la barrera hematoencefálica mucho mejor que otros dos nitrocatecoles, nitecapona y entacapona , porque tiene mayor lipofilia debido a su sustituyente R. [ vago ] Los coeficientes de partición cuantifican la capacidad de la molécula para cruzar la barrera hematoencefálica. LogPIdce= 0,2, –1,4, –0,4 para tolcapone, nitecapona y entacapona respectivamente. Los coeficientes de partición en este caso se midieron en una solución de 1,2-dicloroetano/H2O que hizo que las moléculas estuvieran en forma ionizada. No existe una explicación actual de cómo estas moléculas cargadas permean la barrera hematoencefálica. [19]
Se ha dicho que el tolcapone ingresa al sistema nervioso central solo mínimamente y, por lo tanto, parecería ser periférico-mente selectivo . [6] Sin embargo, el tolcapone es más lipofílico que otros inhibidores de la COMT como el entacapona y puede tener más probabilidades de cruzar la barrera hematoencefálica (BHE). [7] Un estudio de imágenes en humanos encontró que el tolcapone también inhibía la COMT en el cerebro en un grado significativo. [7]
El tolcapone es un compuesto cristalino , no higroscópico , de color amarillo intenso, inodoro y de sabor amargo, con una masa molecular relativa de 273,25 g/mol. Se funde a una temperatura de 143 a 146 °C (289 a 295 °F), es prácticamente insoluble en agua y ácidos, pero soluble en una solución acuosa de hidróxido de sodio 0,1 M. Los valores de p K a son 4,5 y 10,6 para los dos grupos fenilo ; y la absorción máxima es a 268 nm (en ácido clorhídrico 0,1 M /etanol). [11] Su nombre químico es 3,4-dihidroxi-4'-metil-5-nitrobenzofenona.
En 2008 se propuso una síntesis de tolcapona que comienza con una reacción de Grignard entre 3-benciloxi-4-metoxibenzaldehído [20] [21] y bromuro de p -tolilmagnesio. El alcohol así producido se convierte luego en una cetona utilizando t -butóxido de sodio. El grupo protector bencilo se elimina mediante hidrogenación catalizada por paladio en presencia de formiato de amonio. Se introduce un grupo nitro en la posición 5 adyacente al grupo hidroxilo desenmascarado en la escisión del éter bencílico. La síntesis finaliza con la escisión del grupo metoxi utilizando cloruro de aluminio para producir el alcohol producto. [22]

El tolcapone se introdujo en el mercado europeo en agosto de 1997 y, posteriormente, en el mercado estadounidense en marzo de 1998. Se informó de toxicidad hepática en cuatro personas a las que se les administró tolcapone y tres personas murieron debido a complicaciones. En consecuencia, la autorización de comercialización del tolcapone se suspendió desde diciembre de 1998 hasta agosto de 2004, cuando se levantó. En noviembre de 1998, la empresa que fabricaba el tolcapone retiró voluntariamente [23] el fármaco del mercado. La autorización se renovó en agosto de 2009. [24]
Como resultado de las complicaciones reportadas, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) emitió una advertencia de recuadro negro para el tolcapone y revisiones de la etiqueta que apuntaban a regular el monitoreo de aquellos a quienes se les prescribe tolcapone para la enfermedad de Parkinson en noviembre de 1998. [25] Varios otros países retiraron el tolcapone del mercado: Australia en febrero de 1999, Bulgaria en abril de 1999, Islandia en noviembre de 1998, Lituania en diciembre de 1998. [23]
Debido a que los datos preliminares sugerían que el fármaco podría tener actividad, en 2013 la FDA de los EE. UU. otorgó al tolcapone el estatus de "medicamento huérfano" en estudios destinados al tratamiento de la amiloidosis familiar por transtiretina (ATTR). [26] Sin embargo, en 2015 [actualizar]la FDA no había aprobado el tolcapone para el tratamiento de esta enfermedad. [27]
En estudios con animales , el tolcapone muestra efectos antidepresivos y antianhedónicos , estimula el comportamiento exploratorio y mejora la hiperactividad locomotora inducida por psicoestimulantes como la anfetamina y la nomifensina . [28] [29] [30] El tolcapone se ha estudiado clínicamente en el tratamiento de ciertos trastornos psiquiátricos como el trastorno obsesivo-compulsivo (TOC). [31] [32] También existe interés en los inhibidores de la COMT que penetran el cerebro como el tolcapone para el tratamiento de la esquizofrenia [31] [33] así como trastornos de motivación disminuida como la apatía . [34]
La eficacia del tolcapone como complemento de la levodopa en pacientes con enfermedad de Parkinson se ha atribuido principalmente a su capacidad para inhibir la actividad periférica; se cree que el tolcapone entra en el SNC solo en una medida mínima.[16] Sin embargo, los resultados [17] de un estudio en pacientes con enfermedad de Parkinson, así como los resultados de estudios en animales,[18-21] sugieren que el tolcapone también tiene actividad central.
El posible efecto central del tolcapona, que es más lipofílico que el entacapona y puede tener más probabilidades de cruzar la barrera hematoencefálica (BHE), ha sido objeto de debate durante muchos años.26 Una emisión de positrones de (18)F-dopa Un estudio de tomografía computarizada mostró su efecto como inhibidor central de la COMT.27 Sin embargo, este efecto no se tradujo en un beneficio clínico en pacientes sin tratamiento previo con L-dopa, en quienes se comparó tolcapona sola o añadida a selegilina con placebo.28 La tolcapona es más eficaz que la entacapona. , ya que reduce el tiempo total de apagado en un promedio de 98 minutos diarios.
También mejora la hiperactividad locomotora inducida por anfetamina y nomifensina y la estereotipia inducida por anfetamina, y estimula la actividad exploratoria en la prueba de campo abierto en ratas y ratones.14 El tolcapone potencia el antagonismo de la levodopa de la catalepsia inducida por haloperidol en ratones con lesiones MPP+ (modelo murino de la enfermedad de Parkinson) y potencia y prolonga el comportamiento circular inducido por levodopa en ratas con lesiones de la vía nigroestriatal inducidas por 6-hidroxidopamina (otro modelo animal de la enfermedad de Parkinson).23, 24 [...] El efecto del tolcapone en modelos animales de depresión se evaluó en dos estudios. En ratas con anhedonia crónica leve inducida por estrés, la administración de tolcapona 10 o 30 mg/kg dos veces al día mediante inyección intraperitoneal previno el estado anhedónico inducido por estrés en comparación con los controles tratados con el vehículo.28 Otro estudio en ratas que utilizó la prueba de natación forzada y el paradigma de indefensión aprendida no encontró actividad antidepresiva significativa del agente.29 Se desconoce la relevancia de estos hallazgos para el tratamiento de la depresión en humanos con enfermedad parkinsoniana y no parkinsoniana.
Se descubrió que la tolcapona administrada 6 h antes de la provocación con anfetamina aumentaba significativamente la actividad locomotora en ratas tratadas con 0,5 y 2,0 mg kg-1 de anfetamina. En ratas a las que se les administró 4,0 mg kg-1 de anfetamina, la tolcapona produjo una marcada disminución de la actividad locomotora y aumentó al doble la duración del comportamiento estereotipado.