El ensayo inmunoabsorbente ligado a enzimas ( ELISA ) ( / ɪ ˈ l aɪ z ə / , / ˌ iː ˈ l aɪ z ə / ) es un ensayo de bioquímica analítica de uso común , descrito por primera vez por Eva Engvall y Peter Perlmann en 1971. [1] El ensayo es un tipo de inmunoensayo enzimático (EIA) en fase sólida para detectar la presencia de un ligando (comúnmente una proteína) en una muestra líquida utilizando anticuerpos dirigidos contra el ligando que se va a medir. ELISA se ha utilizado como herramienta de diagnóstico en medicina, patología vegetal y biotecnología , así como un control de calidad en varias industrias.
En la forma más simple de una prueba ELISA, los antígenos de la muestra que se va a analizar se adhieren a una superficie. Luego, se aplica un anticuerpo correspondiente sobre la superficie para que pueda unirse al antígeno. Este anticuerpo se une a una enzima y luego se eliminan los anticuerpos que no se hayan unido. En el paso final, se agrega una sustancia que contiene el sustrato de la enzima . Si hubo unión, la reacción posterior produce una señal detectable, generalmente un cambio de color.
Para realizar una prueba ELISA se necesita al menos un anticuerpo con especificidad para un antígeno en particular. La muestra con una cantidad desconocida de antígeno se inmoviliza sobre un soporte sólido (normalmente una microplaca de poliestireno ) de forma no específica (mediante adsorción a la superficie) o específica (mediante captura por otro anticuerpo específico para el mismo antígeno, en una prueba ELISA tipo "sándwich"). Una vez inmovilizado el antígeno, se añade el anticuerpo de detección, que forma un complejo con el antígeno. El anticuerpo de detección puede estar unido covalentemente a una enzima o puede ser detectado por un anticuerpo secundario que esté unido a una enzima mediante bioconjugación . Entre cada paso, la placa se lava normalmente con una solución de detergente suave para eliminar cualquier proteína o anticuerpo que esté unido de forma no específica. Después del paso de lavado final, la placa se revela añadiendo un sustrato enzimático para producir una señal visible , que indica la cantidad de antígeno en la muestra.
Cabe destacar que la ELISA puede realizar otras formas de ensayos de unión de ligandos en lugar de ensayos estrictamente "inmunológicos", aunque el nombre llevaba el "inmunológico" original debido al uso común y la historia del desarrollo de este método. La técnica requiere esencialmente cualquier reactivo de ligamiento que pueda inmovilizarse en la fase sólida junto con un reactivo de detección que se unirá específicamente y utilizará una enzima para generar una señal que pueda cuantificarse adecuadamente. Entre los lavados, solo el ligando y sus contrapartes de unión específica permanecen específicamente unidos o "inmunosorbidos" por interacciones antígeno-anticuerpo a la fase sólida, mientras que los componentes no específicos o no unidos se eliminan por lavado. A diferencia de otros formatos de ensayos espectrofotométricos de laboratorio húmedo donde el mismo pocillo de reacción (por ejemplo, una cubeta) se puede reutilizar después del lavado, las placas ELISA tienen los productos de reacción inmunosorbidos en la fase sólida, que es parte de la placa, y por lo tanto no son fácilmente reutilizables.
Como ensayo de bioquímica analítica y técnica de "laboratorio húmedo", la ELISA implica la detección de un analito (es decir, la sustancia específica cuya presencia se analiza cuantitativa o cualitativamente) en una muestra líquida mediante un método que continúa utilizando reactivos líquidos durante el análisis (es decir, una secuencia controlada de reacciones bioquímicas que generarán una señal que se puede cuantificar e interpretar fácilmente como una medida de la cantidad de analito en la muestra) que permanece líquido y permanece dentro de una cámara de reacción o pozo necesario para mantener los reactivos contenidos. [2] [3] Esto contrasta con las técnicas de "laboratorio seco" que utilizan tiras secas. Incluso si la muestra es líquida (por ejemplo, una pequeña gota medida), el paso de detección final en el análisis "seco" implica la lectura de una tira seca mediante métodos como la reflectometría y no necesita una cámara de contención de la reacción para evitar derrames o mezclas entre muestras. [4]
Como ensayo heterogéneo, el ELISA separa algún componente de la mezcla de reacción analítica mediante la adsorción de ciertos componentes en una fase sólida que está físicamente inmovilizada. En el ELISA, se añade una muestra líquida a una fase sólida estacionaria con propiedades de unión especiales y es seguida por múltiples reactivos líquidos que se añaden, incuban y lavan secuencialmente, seguido de algún cambio óptico (por ejemplo, desarrollo de color por el producto de una reacción enzimática) en el líquido final en el pocillo a partir del cual se mide la cantidad del analito. La "lectura" cuantitativa se basa habitualmente en la detección de la intensidad de la luz transmitida por espectrofotometría , que implica la cuantificación de la transmisión de alguna longitud de onda específica de luz a través del líquido (así como del fondo transparente del pocillo en el formato de placa de pocillos múltiples). [2] [3] La sensibilidad de la detección depende de la amplificación de la señal durante las reacciones analíticas. Dado que las reacciones enzimáticas son procesos de amplificación muy conocidos, la señal es generada por enzimas que están ligadas a los reactivos de detección en proporciones fijas para permitir una cuantificación precisa, de ahí el nombre "enzimáticamente ligada". [5]
El analito también se denomina ligando porque se unirá o ligará específicamente a un reactivo de detección, por lo que el ELISA se incluye en la categoría más grande de ensayos de unión de ligando . [2] El reactivo de unión específico del ligando está "inmovilizado", es decir, generalmente recubierto y secado sobre el fondo transparente y, a veces, también sobre la pared lateral de un pocillo [6] (la "fase sólida"/"sustrato sólido" estacionario aquí en contraposición a las micropartículas/perlas sólidas que se pueden lavar), que generalmente se construye como una placa de múltiples pocillos conocida como "placa ELISA". Convencionalmente, como otras formas de inmunoensayos , se utiliza la especificidad de la reacción de tipo antígeno - anticuerpo porque es fácil generar un anticuerpo específicamente contra un antígeno a granel como reactivo. Alternativamente, si el analito en sí es un anticuerpo, su antígeno objetivo se puede utilizar como reactivo de unión. [7]
Antes del desarrollo de la ELISA, la única opción para realizar un inmunoensayo era el radioinmunoensayo , una técnica que utiliza antígenos o anticuerpos marcados radiactivamente . En el radioinmunoensayo, la radiactividad proporciona la señal que indica si un antígeno o anticuerpo específico está presente en la muestra. El radioinmunoensayo fue descrito por primera vez en un artículo científico de Rosalyn Sussman Yalow y Solomon Berson publicado en 1960. [8]
Como la radiactividad representa una amenaza potencial para la salud, se buscó una alternativa más segura. Una alternativa adecuada al radioinmunoensayo sustituiría la señal radiactiva por una señal no radiactiva. Cuando las enzimas (como la peroxidasa de rábano picante ) reaccionan con sustratos apropiados (como ABTS o TMB ), se produce un cambio de color, que se utiliza como señal. Sin embargo, la señal tiene que estar asociada a la presencia de anticuerpo o antígeno, por lo que la enzima tiene que estar vinculada a un anticuerpo apropiado. Este proceso de unión fue desarrollado independientemente por Stratis Avrameas y GB Pierce. [9] Dado que es necesario eliminar cualquier anticuerpo o antígeno no unido mediante lavado, el anticuerpo o antígeno tiene que estar fijado a la superficie del recipiente; es decir, se debe preparar el inmunosorbente. Wide y Jerker Porath publicaron una técnica para lograr esto en 1966. [10]
En 1971, Peter Perlmann y Eva Engvall de la Universidad de Estocolmo en Suecia, y Anton Schuurs y Bauke van Weemen en los Países Bajos publicaron de forma independiente artículos que sintetizaban este conocimiento en métodos para realizar EIA/ELISA. [11] [12]
El ELISA tradicional generalmente implica reporteros cromogénicos y sustratos que producen algún tipo de cambio de color observable para indicar la presencia de antígeno o analito. Las técnicas más nuevas similares al ELISA utilizan reporteros fluorogénicos , electroquimioluminiscentes y de PCR cuantitativa para crear señales cuantificables. Estos nuevos reporteros pueden tener varias ventajas, incluidas mayores sensibilidades y multiplexación . [13] [14] En términos técnicos, los ensayos más nuevos de este tipo no son estrictamente ELISA, ya que no están "ligados a enzimas", sino que están vinculados a algún reportero no enzimático. Sin embargo, dado que los principios generales de estos ensayos son en gran medida similares, a menudo se agrupan en la misma categoría que los ELISA.
En 2012, una prueba ELISA ultrasensible basada en enzimas que utiliza nanopartículas como indicador cromogénico fue capaz de dar una señal de color a simple vista, a partir de la detección de meros atogramos de analito. Aparece un color azul para los resultados positivos y un color rojo para los negativos. Tenga en cuenta que esta detección solo puede confirmar la presencia o ausencia de analito, no la concentración real. [15]
Existen muchas pruebas ELISA para moléculas específicas que utilizan los anticuerpos correspondientes. Las pruebas ELISA se dividen en varios tipos de pruebas según cómo se unen y utilizan los analitos y los anticuerpos. [16] [17] Los tipos principales se describen aquí. [18]
Los pasos de la prueba ELISA directa [19] siguen el mecanismo que se detalla a continuación:
La enzima actúa como un amplificador; incluso si sólo quedan unidos unos pocos anticuerpos ligados a la enzima, las moléculas de la enzima producirán muchas moléculas señalizadoras. Dentro de las limitaciones del sentido común, la enzima puede seguir produciendo color indefinidamente, pero cuanto más anticuerpo esté unido, más rápido se desarrollará el color. Una desventaja importante del ELISA directo es que el método de inmovilización del antígeno no es específico; cuando se utiliza suero como fuente de antígeno de prueba, todas las proteínas de la muestra pueden adherirse al pocillo de la placa de microtitulación, por lo que pequeñas concentraciones de analito en el suero deben competir con otras proteínas del suero cuando se unen a la superficie del pocillo. El ELISA indirecto o de sándwich proporciona una solución a este problema, al utilizar un anticuerpo de "captura" específico para el antígeno de prueba para extraerlo de la mezcla molecular del suero. [ cita requerida ]
La prueba ELISA puede realizarse en formato cualitativo o cuantitativo. Los resultados cualitativos proporcionan un resultado positivo o negativo simple (sí o no) para una muestra. El punto de corte entre positivo y negativo lo determina el analista y puede ser estadístico. A menudo se utiliza el doble o el triple de la desviación estándar (error inherente a una prueba) para distinguir las muestras positivas de las negativas. En la prueba ELISA cuantitativa, la densidad óptica (DO) de la muestra se compara con una curva estándar, que normalmente es una dilución seriada de una solución de concentración conocida de la molécula objetivo. Por ejemplo, si una muestra de prueba arroja una DO de 1,0, el punto de la curva estándar que dio DO = 1,0 debe tener la misma concentración de analito que la muestra. [ cita requerida ]
El uso y significado de los nombres "ELISA indirecto" y "ELISA directo" difiere en la literatura y en los sitios web según el contexto del experimento. Cuando se analiza la presencia de un antígeno, el nombre "ELISA directo" se refiere a un ELISA en el que sólo se utiliza un anticuerpo primario marcado, y el término "ELISA indirecto" se refiere a un ELISA en el que el antígeno se une al anticuerpo primario que luego es detectado por un anticuerpo secundario marcado. En este último caso, un ELISA tipo sándwich es claramente distinto de un ELISA indirecto. Cuando el anticuerpo "primario" es de interés, por ejemplo en el caso de los análisis de inmunización, este anticuerpo es detectado directamente por el anticuerpo secundario y el término "ELISA indirecto" se aplica a un entorno con dos anticuerpos. [ cita requerida ]

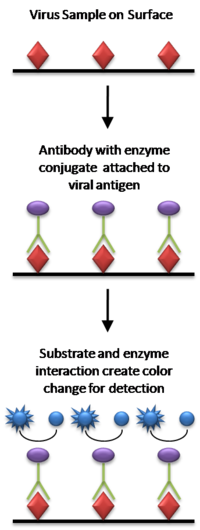
Para detectar el antígeno de la muestra se utiliza una prueba ELISA tipo "sándwich". [20] Los pasos son los siguientes:
La imagen de la derecha incluye el uso de un anticuerpo secundario conjugado con una enzima, aunque, en el sentido técnico, esto no es necesario si el anticuerpo primario está conjugado con una enzima (lo que sería un ELISA directo). Sin embargo, el uso de un conjugado de anticuerpo secundario evita el costoso proceso de crear anticuerpos ligados a enzimas para cada antígeno que se quiera detectar. Al utilizar un anticuerpo ligado a enzimas que se une a la región Fc de otros anticuerpos, este mismo anticuerpo ligado a enzimas se puede utilizar en una variedad de situaciones. Sin la primera capa de anticuerpo de "captura", cualquier proteína en la muestra (incluidas las proteínas séricas) puede adsorberse competitivamente a la superficie de la placa, lo que reduce la cantidad de antígeno inmovilizado. El uso del anticuerpo específico purificado para unir el antígeno al plástico elimina la necesidad de purificar el antígeno de mezclas complicadas antes de la medición, lo que simplifica el ensayo y aumenta la especificidad y la sensibilidad del ensayo. Por lo tanto, un ELISA tipo sándwich utilizado para la investigación a menudo necesita validación, para reducir el riesgo de resultados falsos positivos. [21]
Un tercer uso de la ELISA es la unión competitiva. Los pasos para esta ELISA son algo diferentes a los de los dos primeros ejemplos:
El anticuerpo no marcado se incuba en presencia de su antígeno (muestra).
Algunos kits de ELISA competitivos incluyen antígenos ligados a enzimas en lugar de anticuerpos ligados a enzimas. El antígeno marcado compite por los sitios de unión del anticuerpo primario con el antígeno de la muestra (sin marcar). Cuanto menos antígeno haya en la muestra, más antígeno marcado se retendrá en el pocillo y más fuerte será la señal.
Comúnmente, el antígeno no se coloca primero en el pocillo.
Para la detección de anticuerpos contra el VIH, los pocillos de la placa de microtitulación se recubren con el antígeno del VIH. Se utilizan dos anticuerpos específicos, uno conjugado con la enzima y el otro presente en el suero (si el suero es positivo para el anticuerpo). Se produce una competencia acumulativa entre los dos anticuerpos por el mismo antígeno, lo que hace que se observe una señal más fuerte. Los sueros que se van a analizar se añaden a estos pocillos y se incuban a 37 °C, y luego se lavan. Si hay anticuerpos presentes, se produce la reacción antígeno-anticuerpo. No queda ningún antígeno para los anticuerpos específicos contra el VIH marcados con la enzima. Estos anticuerpos permanecen libres tras la adición y se eliminan durante el lavado. Se añade sustrato, pero no hay enzima que actúe sobre él, por lo que un resultado positivo no muestra ningún cambio de color.
Una cuarta prueba ELISA no utiliza los pocillos tradicionales, sino que deja los antígenos suspendidos en el líquido de prueba. [22] [23]
Esta prueba permite marcar y contar varios antígenos al mismo tiempo. Esto permite identificar cepas específicas de bacterias mediante dos (o más) etiquetas de color diferentes. Si ambas etiquetas están presentes en una célula, entonces la célula es de esa cepa específica. Si solo está presente una, no lo es.
Esta prueba se realiza, por lo general, de a una por vez y no se puede realizar con la placa de microtitulación . El equipo necesario suele ser menos complicado y se puede utilizar en el campo.
En la siguiente tabla se enumeran los marcadores enzimáticos comúnmente utilizados en los ensayos ELISA, que permiten medir los resultados del ensayo una vez finalizado.

Debido a que la ELISA se puede realizar para evaluar la presencia de antígeno o la presencia de anticuerpo en una muestra, es una herramienta útil para determinar las concentraciones de anticuerpos séricos (como con la prueba del VIH [26] o el virus del Nilo Occidental ). También ha encontrado aplicaciones en la industria alimentaria para detectar posibles alérgenos alimentarios , como leche , maní , nueces , almendras y huevos [27] y como prueba de sangre serológica para la enfermedad celíaca . [28] [29] ELISA también se puede utilizar en toxicología como una prueba presuntiva rápida para ciertas clases de medicamentos.

La prueba ELISA fue la primera prueba de detección del VIH ampliamente utilizada debido a su alta sensibilidad. En una prueba ELISA, el suero de una persona se diluye 400 veces y se aplica a una placa a la que se adhieren los antígenos del VIH. Si hay anticuerpos contra el VIH en el suero, pueden unirse a estos antígenos del VIH. Luego se lava la placa para eliminar todos los demás componentes del suero. Luego se aplica a la placa un "anticuerpo secundario" especialmente preparado (un anticuerpo que se une a otros anticuerpos), seguido de otro lavado. Este anticuerpo secundario se une químicamente de antemano a una enzima.
De esta forma, la placa contendrá enzima en proporción a la cantidad de anticuerpo secundario unido a la placa. Se aplica un sustrato para la enzima y la catálisis por la enzima produce un cambio de color o fluorescencia. Los resultados de la prueba ELISA se informan como un número; el aspecto más controvertido de esta prueba es determinar el punto de corte entre un resultado positivo y uno negativo.
Se puede determinar un punto de corte comparándolo con un estándar conocido. Si se utiliza una prueba ELISA para la detección de drogas en el lugar de trabajo, se establece una concentración de corte, 50 ng/ml, por ejemplo, y se prepara una muestra que contiene la concentración estándar del analito. Los valores desconocidos que generan una señal más fuerte que la muestra conocida son "positivos". Los que generan una señal más débil son "negativos".
Existen pruebas ELISA para detectar varios tipos de enfermedades, como el dengue , la malaria , la enfermedad de Chagas , [30] la enfermedad de Johne y otras. [31] Las pruebas ELISA también se emplean ampliamente para diagnósticos in vitro en laboratorios médicos . Otros usos de ELISA incluyen:

ELISA es a partir de 2023 el método principal de detección de patógenos vegetales en todo el mundo. [33]
eSimoa (matriz de moléculas individuales ligadas a enzimas) representa una evolución significativa de la técnica tradicional ELISA (ensayo inmunoabsorbente ligado a enzimas), que se utiliza ampliamente en el diagnóstico clínico y la investigación. Al mejorar significativamente la sensibilidad y la resolución de la detección biomolecular, eSimoa amplía las capacidades de ELISA, lo que permite la detección de biomoléculas en concentraciones que antes no se podían lograr con los ensayos estándar. [34]
Basándose en los principios básicos de ELISA, eSimoa emplea perlas paramagnéticas para aislar biomoléculas o enzimas de una manera similar a la detección basada en placas de ELISA. Sin embargo, eSimoa avanza en este concepto al permitir mediciones de reacciones enzimáticas a nivel de molécula única, lo que mejora drásticamente los límites de detección para varias enzimas y biomoléculas. Este método permite la cuantificación precisa de proteínas de baja abundancia y la actividad de enzimas críticas como las proteínas quinasas y las telomerasas, que a menudo están por debajo del umbral de detección del ELISA convencional.
La mayor sensibilidad de eSimoa es crucial para la detección temprana y precisa de biomarcadores en el diagnóstico clínico, lo que facilita un mejor control y manejo de la enfermedad. En el descubrimiento de fármacos, la capacidad de rastrear cambios sutiles en la actividad enzimática ayuda al desarrollo de fármacos más efectivos al brindar información detallada sobre los mecanismos de inhibición enzimática.
Chi-An Cheng de la Universidad Nacional de Taiwán (NTU) ha afirmado que su equipo desarrolló esta tecnología innovadora. [35] [36] Sin embargo, esta afirmación es cuestionada por la existencia de publicaciones anteriores del equipo de David R. Walt en la Universidad de Harvard, que publicó su trabajo sobre eSimoa en 2020. [37] [38] Esta documentación anterior del equipo de Walt sugiere una contribución previa al desarrollo de la tecnología.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: Requiere citar revista |journal=( ayuda ) [ enlace muerto permanente ]