Una célula de biocombustible enzimática es un tipo específico de célula de combustible que utiliza enzimas como catalizador para oxidar su combustible, en lugar de metales preciosos. Las células de biocombustible enzimáticas , si bien actualmente se limitan a las instalaciones de investigación, son muy apreciadas por la promesa que ofrecen en términos de componentes y combustibles relativamente económicos, así como por su potencial como fuente de energía para implantes biónicos .
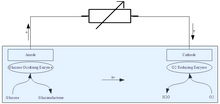
Las células de biocombustible enzimáticas funcionan según los mismos principios generales que todas las células de combustible: utilizan un catalizador para separar electrones de una molécula madre y obligarla a rodear una barrera electrolítica a través de un cable para generar una corriente eléctrica. Lo que distingue a la célula de biocombustible enzimática de las células de combustible más convencionales son los catalizadores que utiliza y los combustibles que acepta. Mientras que la mayoría de las células de combustible utilizan metales como el platino y el níquel como catalizadores, la célula de biocombustible enzimática utiliza enzimas derivadas de células vivas (aunque no dentro de células vivas; las células de combustible que utilizan células enteras para catalizar el combustible se denominan células de combustible microbianas ). Esto ofrece un par de ventajas para las células de biocombustible enzimáticas: las enzimas son relativamente fáciles de producir en masa y, por lo tanto, se benefician de las economías de escala , mientras que los metales preciosos deben extraerse y, por lo tanto, tienen un suministro inelástico . Las enzimas también están diseñadas específicamente para procesar compuestos orgánicos como azúcares y alcoholes, que son extremadamente comunes en la naturaleza. La mayoría de los compuestos orgánicos no pueden ser utilizados como combustible por las celdas de combustible con catalizadores metálicos porque el monóxido de carbono formado por la interacción de las moléculas de carbono con el oxígeno durante el funcionamiento de la celda de combustible “envenena” rápidamente los metales preciosos de los que depende la celda, volviéndola inútil. [1] Debido a que los azúcares y otros biocombustibles pueden cultivarse y cosecharse a gran escala, el combustible para las celdas de biocombustible enzimático es extremadamente barato y se puede encontrar en casi cualquier parte del mundo, lo que lo convierte en una opción extraordinariamente atractiva desde un punto de vista logístico, y más aún para aquellos preocupados por la adopción de fuentes de energía renovables .
Las células de combustible enzimáticas también tienen requisitos operativos que no comparten las células de combustible tradicionales. Lo más importante es que las enzimas que permiten que la célula de combustible funcione deben estar “inmovilizadas” cerca del ánodo y el cátodo para que funcionen correctamente; si no están inmovilizadas, las enzimas se difundirán en el combustible de la célula y la mayoría de los electrones liberados no llegarán a los electrodos, comprometiendo su eficacia. [2] Incluso con la inmovilización, también debe proporcionarse un medio para que los electrones se transfieran hacia y desde los electrodos . Esto puede hacerse directamente desde la enzima al electrodo (“transferencia directa de electrones”) o con la ayuda de otros productos químicos que transfieren electrones desde la enzima al electrodo (“transferencia mediada de electrones”). La primera técnica es posible solo con ciertos tipos de enzimas cuyos sitios de activación están cerca de la superficie de la enzima, pero hacerlo presenta menos riesgos de toxicidad para las células de combustible destinadas a ser utilizadas dentro del cuerpo humano. [2] Finalmente, el procesamiento completo de los combustibles complejos utilizados en las células de biocombustible enzimático requiere una serie de enzimas diferentes para cada paso del proceso de "metabolismo"; producir algunas de las enzimas requeridas y mantenerlas en los niveles requeridos puede plantear problemas. [3]
Los primeros trabajos con células de biocombustible, que comenzaron a principios del siglo XX, fueron puramente de variedad microbiana . [1] La investigación sobre el uso directo de enzimas para la oxidación en células de biocombustible comenzó a principios de la década de 1960, y la primera célula de biocombustible enzimática se produjo en 1964. [1] [4] Esta investigación comenzó como producto del interés de la NASA en encontrar formas de reciclar los desechos humanos en energía utilizable a bordo de naves espaciales , así como un componente de la búsqueda de un corazón artificial , específicamente como una fuente de energía que pudiera introducirse directamente en el cuerpo humano. [5] Estas dos aplicaciones (el uso de productos animales o vegetales como combustible y el desarrollo de una fuente de energía que pueda implantarse directamente en el cuerpo humano sin reabastecimiento externo) siguen siendo los objetivos principales para el desarrollo de estas células de biocombustible. [6] Sin embargo, los resultados iniciales fueron decepcionantes. Aunque las primeras células producían electricidad con éxito , existían dificultades para transportar los electrones liberados del combustible de glucosa al electrodo de la célula de combustible y otras dificultades para mantener el sistema lo suficientemente estable como para producir electricidad debido a la tendencia de las enzimas a alejarse de donde debían estar para que la célula de combustible funcionara. [2] Estas dificultades llevaron a que los investigadores de células de biocombustible abandonaran el modelo enzima-catalizador durante casi tres décadas en favor de los catalizadores metálicos más convencionales (principalmente platino), que se utilizan en la mayoría de las células de combustible. [2] La investigación sobre el tema no comenzó de nuevo hasta la década de 1980, después de que se comprendiera que el método de catalizador metálico no iba a poder ofrecer las cualidades deseadas en una célula de biocombustible, y desde entonces el trabajo en células de biocombustible enzimáticas ha girado en torno a la resolución de los diversos problemas que plagaron los esfuerzos anteriores para producir una célula de biocombustible enzimática exitosa. [2]
Sin embargo, muchos de estos problemas se resolvieron en 1998. En ese año, se anunció que los investigadores habían logrado oxidar completamente el metanol utilizando una serie (o "cascada") de enzimas en una celda de biocombustible. [7] Antes de este momento, los catalizadores enzimáticos no habían logrado oxidar completamente el combustible de la celda, entregando cantidades mucho menores de energía de lo que se esperaba dado lo que se sabía sobre la capacidad energética del combustible. [3] Si bien el metanol ahora es mucho menos relevante en este campo como combustible, el método demostrado de usar una serie de enzimas para oxidar completamente el combustible de la celda dio a los investigadores un camino a seguir, y ahora se dedica mucho trabajo al uso de métodos similares para lograr la oxidación completa de compuestos más complicados, como la glucosa. [2] [3] Además, y quizás lo que es más importante, 1998 fue el año en el que se demostró con éxito la "inmovilización" enzimática, lo que aumentó la vida útil de la celda de combustible de metanol de solo ocho horas a más de una semana. [2] La inmovilización también proporcionó a los investigadores la capacidad de poner en práctica descubrimientos anteriores, en particular el descubrimiento de enzimas que pueden usarse para transferir electrones directamente desde la enzima al electrodo. Este proceso se había entendido desde la década de 1980, pero dependía en gran medida de colocar la enzima lo más cerca posible del electrodo, lo que significaba que era inutilizable hasta después de que se idearan las técnicas de inmovilización. [2] Además, los desarrolladores de biocélulas enzimáticas han aplicado algunos de los avances en nanotecnología a sus diseños, incluido el uso de nanotubos de carbono para inmovilizar enzimas directamente. [2] Otras investigaciones se han centrado en explotar algunas de las fortalezas del diseño enzimático para miniaturizar drásticamente las celdas de combustible, un proceso que debe ocurrir si estas celdas alguna vez se van a utilizar con dispositivos implantables . Un equipo de investigación aprovechó la extrema selectividad de las enzimas para eliminar por completo la barrera entre el ánodo y el cátodo , que es un requisito absoluto en las celdas de combustible que no son de tipo enzimático. Esto permitió al equipo producir una celda de combustible que produce 1,1 microvatios operando a más de medio voltio en un espacio de apenas 0,01 milímetros cúbicos . [2]
Aunque las células de biocombustible enzimático no se utilizan actualmente fuera del laboratorio, a medida que la tecnología ha avanzado durante la última década, las organizaciones no académicas han mostrado un creciente interés en las aplicaciones prácticas de los dispositivos. En 2007, Sony anunció que había desarrollado una célula de biocombustible enzimático que se puede conectar en secuencia y utilizar para alimentar un reproductor de mp3 , [8] y en 2010 un ingeniero empleado por el ejército de los EE. UU. anunció que el Departamento de Defensa planeaba realizar pruebas de campo de sus propias "biobaterías" en el año siguiente. [9] Al explicar su búsqueda de la tecnología, ambas organizaciones enfatizaron la extraordinaria abundancia (y el costo extraordinariamente bajo) de combustible para estas células, una ventaja clave de la tecnología que probablemente se vuelva aún más atractiva si el precio de las fuentes de energía portátiles aumenta, o si se pueden integrar con éxito en implantes humanos electrónicos.
En lo que respecta a las pilas de combustible, las enzimas tienen varias ventajas para su incorporación. Una propiedad enzimática importante a tener en cuenta es la fuerza impulsora o potencial necesario para una catálisis de reacción exitosa . Muchas enzimas operan a potenciales cercanos a sus sustratos, lo que resulta más adecuado para aplicaciones de pilas de combustible. [10] [11]
Además, la matriz proteica que rodea el sitio activo proporciona muchas funciones vitales; selectividad para el sustrato, acoplamiento electrónico interno, propiedades ácidas/básicas y la capacidad de unirse a otras proteínas (o al electrodo). [10] [11] Las enzimas son más estables en ausencia de proteasas , mientras que las enzimas resistentes al calor se pueden extraer de organismos termófilos , ofreciendo así un rango más amplio de temperaturas operativas. Las condiciones operativas son generalmente entre 20-50 °C y pH 4.0 a 8.0. [10] [11]
Una desventaja del uso de enzimas es el tamaño; dado el gran tamaño de las enzimas, producen una baja densidad de corriente por unidad de área de electrodo debido al espacio limitado. Dado que no es posible reducir el tamaño de las enzimas, se ha argumentado que estos tipos de células tendrán una menor actividad. Una solución ha sido utilizar electrodos tridimensionales o inmovilización sobre soportes de carbono conductores que proporcionan una gran área de superficie. Estos electrodos se extienden en el espacio tridimensional, lo que aumenta en gran medida el área de superficie para que las enzimas se unan, aumentando así la corriente. [10] [11]
Según la definición de las bioceldas, las enzimas se utilizan como electrocatalizadores tanto en el cátodo como en el ánodo. En las bioceldas basadas en hidrogenasas , las hidrogenasas están presentes en el ánodo para la oxidación del H2, en la que el hidrógeno molecular se divide en electrones y protones. En el caso de las bioceldas de H2/O2, el cátodo está recubierto con enzimas oxidasas que luego convierten los protones en agua. [12]
En los últimos años, la investigación sobre hidrogenasas ha crecido significativamente debido al interés científico y tecnológico en el hidrógeno. La reacción bidireccional o reversible catalizada por hidrogenasa es una solución al desafío en el desarrollo de tecnologías para la captura y almacenamiento de energía renovable como combustible con uso bajo demanda. Esto se puede demostrar a través del almacenamiento químico de electricidad obtenida de una fuente renovable (por ejemplo, solar, eólica, hidrotermal ) como H 2 durante períodos de baja demanda energética. Cuando se desea energía, el H 2 se puede oxidar para producir electricidad lo cual es muy eficiente. [12]
El uso de hidrógeno en dispositivos de conversión de energía ha ganado interés debido a que es un portador de energía limpia y un combustible potencial para el transporte. [12]
Además de las ventajas mencionadas anteriormente asociadas con la incorporación de enzimas en las celdas de combustible, la hidrogenasa es un catalizador muy eficiente para el consumo de H2 formando electrones y protones. El platino es típicamente el catalizador para esta reacción, sin embargo, la actividad de las hidrogenasas es comparable sin el problema del envenenamiento del catalizador por H2S y CO. [12] En el caso de las celdas de combustible de H2 / O2 , no hay producción de gases de efecto invernadero cuando el producto es agua. [12]
En cuanto a las ventajas estructurales, la hidrogenasa es altamente selectiva para su sustrato. La falta de necesidad de una membrana simplifica el diseño de la celda de biocombustible para que sea pequeña y compacta, [12] dado que la hidrogenasa no reacciona con el oxígeno (un inhibidor ) y las enzimas del cátodo (normalmente lacasa ) no reaccionan con el combustible. Los electrodos están hechos preferiblemente de carbono, que es abundante, renovable y puede modificarse de muchas maneras o adsorber enzimas con alta afinidad. La hidrogenasa está unida a una superficie que también extiende la vida útil de la enzima. [10] [11]
Existen varias dificultades asociadas a la incorporación de hidrogenasa en las biopilas de combustible que deben tenerse en cuenta para producir una pila de combustible eficiente.
Dado que la célula de biocombustible basada en hidrogenasa alberga una reacción redox , la hidrogenasa debe inmovilizarse en el electrodo de tal manera que pueda intercambiar electrones directamente con el electrodo para facilitar la transferencia de electrones. Esto resulta un desafío ya que el sitio activo de la hidrogenasa está enterrado en el centro de la enzima, donde los grupos de FeS se utilizan como un relé de electrones para intercambiar electrones con su socio redox natural. [12]
Las posibles soluciones para lograr una mayor eficiencia en la transferencia de electrones incluyen la inmovilización de la hidrogenasa con el grupo de FeS más expuesto lo suficientemente cerca del electrodo o el uso de un mediador redox para llevar a cabo la transferencia de electrones. La transferencia directa de electrones también es posible mediante la adsorción de la enzima en electrodos de grafito o la unión covalente al electrodo. Otra solución incluye el atrapamiento de la hidrogenasa en un polímero conductor. [12]
La comparación inmediata del tamaño de la hidrogenasa con los catalizadores moleculares inorgánicos estándar revela que la hidrogenasa es muy voluminosa. Tiene un diámetro de aproximadamente 5 nm en comparación con los 1-5 nm de los catalizadores de Pt. Esto limita la posible cobertura del electrodo al limitar la densidad de corriente máxima. [12]
Dado que no es posible alterar el tamaño de la hidrogenasa, para aumentar la densidad de la enzima presente en el electrodo y mantener la actividad de la celda de combustible, se puede utilizar un electrodo poroso en lugar de uno plano. Esto aumenta el área electroactiva, lo que permite cargar más enzima en el electrodo. Una alternativa es formar películas con partículas de grafito adsorbidas con la hidrogenasa dentro de una matriz de polímero . Las partículas de grafito pueden entonces recolectar y transportar electrones a la superficie del electrodo. [12]
En una célula de biocombustible, la hidrogenasa está expuesta a dos amenazas oxidantes. El O2 inactiva la mayoría de las hidrogenasas con la excepción de [NiFe] a través de la difusión de O2 al sitio activo seguida de una modificación destructiva del sitio activo . El O2 es el combustible en el cátodo y por lo tanto debe estar separado físicamente o de lo contrario las enzimas hidrogenasas en el ánodo se inactivarían. En segundo lugar, existe un potencial positivo impuesto sobre la hidrogenasa en el ánodo por la enzima en el cátodo. Esto mejora aún más la inactivación de la hidrogenasa por el O2, lo que hace que incluso [NiFe], que anteriormente era tolerante al O2, se vea afectado. [12]
Para evitar la inactivación por O 2 , se puede utilizar una membrana de intercambio de protones para separar los compartimentos del ánodo y del cátodo de modo que el O 2 no pueda difundirse y modificar destructivamente el sitio activo de la hidrogenasa. [12]
Existen muchas formas de adsorber hidrogenasas en electrodos de carbono modificados con polímeros. Un ejemplo es un estudio realizado por Morozov et al., en el que insertaron hidrogenasa NiFe en películas de polipirrol y, para proporcionar un contacto adecuado con el electrodo, se atraparon mediadores redox en la película. Esto tuvo éxito porque la densidad de hidrogenasa era alta en las películas y el mediador redox ayudó a conectar todas las moléculas de enzima para la catálisis, que tenía aproximadamente la misma potencia de salida que la hidrogenasa en solución. [11]
Los nanotubos de carbono también pueden utilizarse como soporte para la hidrogenasa en el electrodo debido a su capacidad de ensamblarse en grandes redes porosas y conductoras. Estos híbridos se han preparado utilizando hidrogenasas [FeFe] y [NiFe]. La hidrogenasa [NiFe] aislada de A. aeolicus (bacteria termófila) fue capaz de oxidar H 2 con transferencia electrónica directa sin un mediador redox con una corriente catalítica 10 veces mayor con electrodos estacionarios recubiertos con CNT que con electrodos desnudos. [11]
Otra forma de acoplar la hidrogenasa a los nanotubos fue unirlos covalentemente para evitar un retraso temporal. La hidrogenasa aislada de D. gigas (calamar gigante) se acopló a redes de nanotubos de carbono de paredes múltiples (MWCNT) y produjo una corriente ~30 veces mayor que la del ánodo de grafito-hidrogenasa. Un pequeño inconveniente de este método es que la proporción de hidrogenasa que cubre la superficie de la red de nanotubos deja que la hidrogenasa cubra solo los escasos puntos defectuosos en la red. También se encontró que algunos procedimientos de adsorción tienden a dañar las enzimas, mientras que su acoplamiento covalente estabilizó la enzima y le permitió permanecer estable durante más tiempo. La actividad catalítica de los electrodos de hidrogenasa-MWCNT proporcionó estabilidad durante más de un mes, mientras que los electrodos de hidrogenasa-grafito solo duraron aproximadamente una semana. [11]
El grupo Armstrong construyó una pila de combustible de hidrógeno totalmente enzimática que la utilizó para alimentar un reloj. La pila de combustible constaba de un ánodo de grafito con hidrogenasa aislada de R. metallidurans y un cátodo de grafito modificado con lacasa fúngica. Los electrodos se colocaron en una única cámara con una mezcla de gas H2 al 3% en aire y no había membrana debido a la tolerancia de la hidrogenasa al oxígeno. La pila de combustible produjo un voltaje de 950 mV y generó 5,2 uW/cm2 de electricidad. Aunque este sistema era muy funcional, todavía no estaba en su nivel óptimo de rendimiento debido a los bajos niveles de H2 accesibles , la menor actividad catalítica de las hidrogenasas tolerantes al oxígeno y la menor densidad de catalizadores en los electrodos planos. [11]
Este sistema se mejoró posteriormente añadiéndole una red MWCNT para aumentar el área del electrodo. [11]
El concepto inicial de aplicar células de biocombustible enzimáticas para aplicaciones de biodetección autoalimentadas se introdujo en 2001. [13] Con esfuerzos continuos, se han demostrado varios tipos de biosensores autoalimentados basados en enzimas. En 2016, se describió el primer ejemplo de células de biocombustible basadas en textiles extensibles, que actúan como sensores autoalimentados portátiles. El dispositivo textil inteligente utilizó una célula de biocombustible basada en lactato oxidasa, lo que permitió el monitoreo en tiempo real del lactato en el sudor para aplicaciones en el cuerpo. [14] [15]