En química orgánica , las reglas de secuencia Cahn-Ingold-Prelog ( CIP ) (también la convención de prioridad CIP ; llamada así en honor a Robert Sidney Cahn , Christopher Kelk Ingold y Vladimir Prelog ) son un proceso estándar para nombrar completa e inequívocamente un estereoisómero de una molécula. . [1] [2] : 26 El propósito del sistema CIP es asignar un descriptor R o S a cada estereocentro y un descriptor E o Z a cada doble enlace de modo que la configuración de toda la molécula pueda especificarse de forma única al incluir el descriptores en su nombre sistemático. Una molécula puede contener cualquier número de estereocentros y cualquier número de dobles enlaces, y cada uno de ellos suele dar lugar a dos posibles isómeros. Una molécula con un número entero n que describe el número de estereocentros generalmente tendrá 2 n estereoisómeros y 2 n −1 diastereómeros , cada uno con un par de enantiómeros asociados . [3] [4] Las reglas de secuencia CIP contribuyen a la denominación precisa de cada estereoisómero de cada molécula orgánica con todos los átomos de ligancia menor que 4 (pero incluyendo también la ligancia de 6; este término se refiere al "número de átomos vecinos "vinculado a un centro). [2] : 26f [4]
El artículo clave que establece las reglas de secuencia del CIP se publicó en 1966, [5] y fue seguido por más refinamientos, [6] antes de que se incorporara a las reglas de la Unión Internacional de Química Pura y Aplicada (IUPAC), el organismo oficial. que define la nomenclatura orgánica , en 1974. [2] : 26 y siguientes. Desde entonces, las reglas han sido revisadas, la más reciente en 2013, [7] como parte del libro de la IUPAC Nomenclatura de química orgánica . La presentación de las reglas de la IUPAC constituye el estándar oficial y formal para su uso, y señala que "el método ha sido desarrollado para cubrir todos los compuestos con ligancia hasta 4... y... [extendido al caso de] ligancia 6... [así como] para todas las configuraciones y conformaciones de dichos compuestos". [2] : 26ff Sin embargo, aunque la documentación de la IUPAC presenta una introducción exhaustiva, incluye la advertencia de que "es esencial estudiar los artículos originales, especialmente el artículo de 1966, antes de utilizar la regla de secuencia para casos que no sean bastante simples". [2] : 26f
Un artículo reciente aboga por cambios en algunas de las reglas (reglas de secuencia 1b y 2) para abordar ciertas moléculas cuyos descriptores correctos no estaban claros. [8] Sin embargo, persiste un problema diferente: en casos raros, dos estereoisómeros diferentes de la misma molécula pueden tener los mismos descriptores CIP, por lo que es posible que el sistema CIP no pueda nombrar de manera inequívoca un estereoisómero, y otros sistemas pueden ser preferibles. [9] : 27
Los pasos para nombrar moléculas usando el sistema CIP a menudo se presentan como:
Los descriptores R / S y E / Z se asignan utilizando un sistema de clasificación de prioridad de los grupos adjuntos a cada estereocentro. Este procedimiento, a menudo conocido como reglas de secuencia , es el corazón del sistema CIP. La descripción general de esta sección omite algunas reglas que sólo son necesarias en casos excepcionales.
Si dos grupos difieren sólo en isótopos , entonces se utiliza la masa atómica mayor para establecer la prioridad. [10]

Si un átomo, A, tiene un doble enlace con otro átomo, entonces el átomo A debe tratarse como si estuviera "conectado al mismo átomo dos veces". [11] Un átomo que tiene un doble enlace tiene mayor prioridad que un átomo que tiene un enlace simple. [11] Cuando se trata de grupos prioritarios de dobles enlaces, se permite visitar el mismo átomo dos veces mientras se crea un arco. [12]
Cuando B se reemplaza con una lista de átomos unidos, A en sí, pero no su "fantasma", queda excluido de acuerdo con el principio general de no duplicarse a lo largo de un enlace que acaba de seguir. Un triple enlace se maneja de la misma manera excepto que A y B están conectados cada uno a dos átomos fantasmas del otro. [2] : 28
Si dos sustituyentes de un átomo son isómeros geométricos entre sí, el isómero Z tiene mayor prioridad que el isómero E. Un estereoisómero que contiene dos grupos de mayor prioridad en la misma cara del doble enlace ( cis ) se clasifica como "Z". El estereoisómero con dos grupos de mayor prioridad en lados opuestos de un doble enlace carbono-carbono ( trans ) se clasifica como "E". [13]
Para manejar una molécula que contiene uno o más ciclos , primero se debe expandirla en un árbol (llamado dígrafo jerárquico ) atravesando enlaces en todos los caminos posibles comenzando en el estereocentro. Cuando el recorrido encuentra un átomo por el cual ya pasó la ruta actual, se genera un átomo fantasma para mantener el árbol finito. Un solo átomo de la molécula original puede aparecer en muchos lugares (algunos como fantasmas, otros no) del árbol. [14] : 572

Un isómero hibridado quiral sp 3 contiene cuatro sustituyentes diferentes. A los cuatro sustituyentes se les asignan proritos en función de sus números atómicos. Una vez que se han asignado sus prioridades a los sustituyentes de un estereocentro , la molécula se orienta en el espacio de modo que el grupo con la prioridad más baja apunte en dirección contraria al observador. Si los sustituyentes están numerados del 1 (prioridad más alta) al 4 (prioridad más baja), entonces el sentido de rotación de una curva que pasa por 1, 2 y 3 distingue los estereoisómeros . En un isómero configuracional , el grupo de menor prioridad (la mayoría de las veces hidrógeno) se coloca detrás del plano o del enlace sombreado que se aleja del lector. El grupo de mayor prioridad tendrá trazado un arco que conectará con el resto de grupos, finalizando en el grupo de tercera prioridad. Un arco dibujado en el sentido de las agujas del reloj tiene la asignación del recto ( R ). Un arco dibujado en sentido antihorario tiene la asignación siniestra ( S ). Los nombres se derivan del latín y significan "derecha" e "izquierda", respectivamente. [15] [16] Al nombrar un isómero orgánico, la abreviatura de recto o asignación siniestra se coloca delante del nombre entre paréntesis. Por ejemplo, el 3-metil-1-penteno con una asignación recta tiene el formato ( R )-3-metil-1-penteno. [12]

Un método práctico para determinar si un enantiómero es R o S es utilizar la regla de la mano derecha : se envuelve la molécula con los dedos en la dirección 1 → 2 → 3 . Si el pulgar apunta en la dirección del cuarto sustituyente, el enantiómero es R ; en caso contrario, es S.
En casos raros, es posible que dos sustituyentes en un átomo difieran sólo en su configuración absoluta ( R o S ). Si es necesario establecer las prioridades relativas de estos sustituyentes, R tiene prioridad sobre S. Cuando esto sucede, el descriptor del estereocentro es una letra minúscula ( r o s ) en lugar de la letra mayúscula que se usa normalmente. [17]
Para moléculas con doble enlace, se siguen las reglas de prioridad de Cahn-Ingold-Prelog (reglas CIP) para determinar la prioridad de los sustituyentes del doble enlace. Si ambos grupos de alta prioridad están en el mismo lado del doble enlace ( configuración cis ), entonces al estereoisómero se le asigna la configuración Z ( zusammen, palabra alemana que significa "juntos"). Si los grupos de alta prioridad están en lados opuestos del doble enlace ( configuración trans ), entonces al estereoisómero se le asigna la configuración E ( entgegen , palabra alemana que significa "opuesto") [18]
En algunos casos donde se forman centros estereogénicos , se debe especificar la configuración. Sin la presencia de una interacción no covalente , un compuesto es aquiral . Algunos profesionales han propuesto una nueva regla para tener en cuenta esto. Esta regla establece que "las interacciones no covalentes tienen un número ficticio entre 0 y 1" a la hora de asignar prioridad. [19] Los compuestos en los que esto ocurre se denominan compuestos de coordinación .
Las estructuras espiro contienen moléculas quirales sin centro asimétrico. Los anillos de una estructura espiro se encuentran en ángulo recto entre sí. Es importante señalar que las imágenes especulares de las estructuras espiro no son superponibles y son enantiómeros. [12]
Los siguientes son ejemplos de aplicación de la nomenclatura. [20]
Si un compuesto tiene más de un estereocentro quiral, cada centro se denota por R o S. Por ejemplo, la efedrina existe en los estereoisómeros (1 R , 2 S ) y (1 S , 2 R ), que son formas especulares distintas entre sí, lo que los convierte en enantiómeros . Este compuesto también existe como los dos enantiómeros escritos (1 R , 2 R ) y (1 S , 2 S ), que se denominan pseudoefedrina en lugar de efedrina. Los cuatro isómeros se denominan 2-metilamino-1-fenil-1-propanol en la nomenclatura sistemática. Sin embargo, la efedrina y la pseudoefedrina son diastereómeros o estereoisómeros que no son enantiómeros porque no están relacionados como copias especulares. La pseudoefedrina y la efedrina reciben nombres diferentes porque, como diastereómeros, tienen propiedades químicas diferentes, incluso para mezclas racémicas de cada una.
De manera más general, para cualquier par de enantiómeros, todos los descriptores son opuestos: ( R , R ) y ( S , S ) son enantiómeros, al igual que ( R , S ) y ( S , R ). Los diastereómeros tienen al menos un descriptor en común; por ejemplo ( R , S ) y ( R , R ) son diastereómeros, al igual que ( S , R ) y ( S , S ). Esto también es válido para compuestos que tienen más de dos estereocentros: si dos estereoisómeros tienen al menos un descriptor en común, son diastereómeros. Si todos los descriptores son opuestos, son enantiómeros.
Un mesocompuesto es una molécula aquiral, a pesar de tener dos o más centros estereogénicos . Un compuesto meso es "superponible" en su imagen especular, por lo tanto reduce el número de estereoisómeros predichos por la regla 2 n . Esto ocurre porque la molécula obtiene un plano de simetría que hace que la molécula gire alrededor del enlace central carbono-carbono. [12] Un ejemplo es el ácido mesotartárico , en el que ( R , S ) es lo mismo que la forma ( S , R ). En los compuestos meso, los estereocentros R y S se encuentran en pares colocados simétricamente. [21]
La configuración relativa de dos estereoisómeros puede indicarse mediante los descriptores R y S con un asterisco (*). ( R *, R *) significa dos centros que tienen configuraciones idénticas, ( R , R ) o ( S , S ); ( R *, S *) significa dos centros que tienen configuraciones opuestas, ( R , S ) o ( S , R ). Para comenzar, el centro estereogénico con el número más bajo (según la numeración sistemática de la IUPAC) recibe el descriptor R *.
Para designar dos anómeros se utilizan los estereodescriptores relativos alfa (α) y beta (β). En el anómero α, el átomo de carbono anomérico y el átomo de referencia tienen configuraciones opuestas ( R , S ) o ( S , R ), mientras que en el anómero β son los mismos ( R , R ) o ( S , S ). [22]
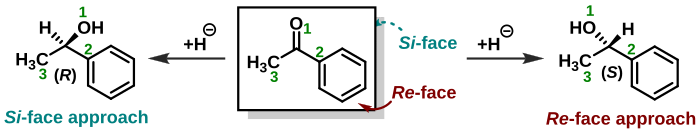
La estereoquímica también juega un papel en la asignación de caras a moléculas trigonales como las cetonas . Un nucleófilo en una adición nucleófila puede acercarse al grupo carbonilo desde dos lados o caras opuestas. Cuando un nucleófilo aquiral ataca a la acetona , ambas caras son idénticas y solo queda un producto de reacción. Cuando el nucleófilo ataca a la butanona , las caras no son idénticas ( enantiotópico ) y se produce un producto racémico . Cuando el nucleófilo es una molécula quiral se forman diastereoisómeros . Cuando una cara de una molécula está protegida por sustituyentes o restricciones geométricas en comparación con la otra cara, las caras se denominan diastereotópicas . Las mismas reglas que determinan la estereoquímica de un estereocentro ( R o S ) también se aplican al asignar la cara de un grupo molecular. Las caras se denominan entonces Re -face y Si -face . [23] [24] En el ejemplo que se muestra a la derecha, el compuesto acetofenona se ve desde la cara Re . La adición de hidruro como en un proceso de reducción desde este lado formará el enantiómero ( S ) y el ataque desde la cara de Si opuesta dará el enantiómero ( R ). Sin embargo, se debe tener en cuenta que agregar un grupo químico al centro proquiral de Re -face no siempre conducirá a un estereocentro ( S ), ya que se debe tener en cuenta la prioridad del grupo químico. Es decir, la estereoquímica absoluta del producto se determina por sí sola y no considerando desde qué cara fue atacado. En el ejemplo mencionado anteriormente, si se agregara cloruro ( Z = 17) al centro proquiral de la cara Re , esto daría como resultado un enantiómero ( R ).