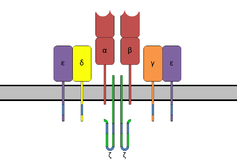
CD3 ( cluster de diferenciación 3) es un complejo proteico y correceptor de células T que participa en la activación tanto de las células T citotóxicas (células T CD8+ vírgenes) como de las células T colaboradoras (células T CD4+ vírgenes). [1] Está compuesto por cuatro cadenas distintas. En los mamíferos, el complejo contiene una cadena CD3γ , una cadena CD3δ y dos cadenas CD3ε . Estas cadenas se asocian con el receptor de células T (TCR) y la CD3-zeta (cadena ζ) para generar una señal de activación en los linfocitos T. El TCR, la CD3-zeta y las otras moléculas CD3 juntas constituyen el complejo TCR.
Las cadenas CD3γ, CD3δ y CD3ε son proteínas de superficie celular altamente relacionadas de la superfamilia de inmunoglobulinas que contienen un solo dominio de inmunoglobulina extracelular .
Se resolvió la estructura de las regiones extracelulares y transmembrana del complejo CD3γε/CD3δε/CD3ζζ/TCRαβ con CryoEM , mostrando por primera vez cómo las regiones transmembrana CD3 encierran las regiones transmembrana TCR en un barril abierto. [2]
Al contener residuos de aspartato , la región transmembrana de las cadenas CD3 está cargada negativamente, una característica que permite que estas cadenas se asocien con las cadenas TCR cargadas positivamente. [3]
Las colas intracelulares de las moléculas CD3γ, CD3ε y CD3δ contienen cada una un único motivo conservado conocido como motivo de activación basado en tirosina del inmunorreceptor , o ITAM por sus siglas en inglés, que es esencial para la capacidad de señalización del TCR. La cola intracelular de CD3ζ contiene 3 motivos ITAM.
La fosforilación del ITAM en CD3 hace que la cadena CD3 sea capaz de unirse a una enzima llamada ZAP70 (proteína asociada a zeta), una quinasa que es importante en la cascada de señalización de la célula T.
Debido a que el CD3 es necesario para la activación de las células T , se están investigando medicamentos (a menudo anticuerpos monoclonales ) que lo atacan como terapias inmunosupresoras (por ejemplo, otelixizumab , teplizumab ) para la diabetes tipo 1 y otras enfermedades autoinmunes . [4]
Se están desarrollando nuevos tratamientos farmacológicos contra el cáncer basados en el correceptor de células T CD3, y se están diseñando moléculas para alterar la señal coestimuladora para ayudar a que las células T reconozcan a las células cancerosas y se activen por completo. Los cánceres que poseen el receptor de punto de control inmunorregulador B7-H3 en la célula tumoral han sido uno de esos objetivos en los ensayos clínicos. Esta proteína B7-H3 se expresa en las células cancerosas para varios tipos de cáncer. A menudo, el fármaco contendrá dos dominios, uno que se une al CD3 de las células T y el otro que se dirige y se une a las células cancerosas.
El CD3 se expresa inicialmente en el citoplasma de los protimocitos, las células madre a partir de las cuales surgen las células T en el timo . Los protimocitos se diferencian en timocitos comunes y luego en timocitos medulares, y es en esta última etapa cuando el antígeno CD3 comienza a migrar a la membrana celular. El antígeno se encuentra unido a las membranas de todas las células T maduras y prácticamente en ningún otro tipo de célula, aunque parece estar presente en pequeñas cantidades en las células de Purkinje .
Esta alta especificidad, combinada con la presencia de CD3 en todas las etapas del desarrollo de las células T, lo convierte en un marcador inmunohistoquímico útil para las células T en secciones de tejido. El antígeno permanece presente en casi todos los linfomas y leucemias de células T y, por lo tanto, se puede utilizar para distinguirlos de neoplasias de células B y mieloides superficialmente similares . [5]