
Las células ganglionares de la retina intrínsecamente fotosensibles ( ipRGC ), también llamadas células ganglionares de la retina fotosensibles ( pRGC ), o células ganglionares de la retina que contienen melanopsina ( mRGC ), son un tipo de neurona en la retina del ojo de los mamíferos . La presencia de un fotorreceptor adicional se sospechó por primera vez en 1927, cuando ratones que carecían de bastones y conos todavía respondían a los cambios en los niveles de luz mediante la constricción de la pupila ; [1] esto sugirió que los bastones y los conos no son el único tejido sensible a la luz. [2] Sin embargo, no estaba claro si esta sensibilidad a la luz surgió de un fotorreceptor retiniano adicional o de otra parte del cuerpo. Investigaciones recientes han demostrado que estas células ganglionares de la retina , a diferencia de otras células ganglionares de la retina, son intrínsecamente fotosensibles debido a la presencia de melanopsina , una proteína sensible a la luz. Por tanto, constituyen una tercera clase de fotorreceptores, además de los bastones y los conos . [3]

En comparación con los bastones y los conos, los ipRGC responden más lentamente y señalan la presencia de luz a largo plazo. [5] Representan un subconjunto muy pequeño (~1%) de las células ganglionares de la retina. [6] Sus roles funcionales no forman imágenes y son fundamentalmente diferentes de los de la visión de patrones; Proporcionan una representación estable de la intensidad de la luz ambiental. Tienen al menos tres funciones principales:
Se han aislado células ganglionares fotorreceptivas en humanos, donde, además de regular el ritmo circadiano, se ha demostrado que median en cierto grado de reconocimiento de la luz en sujetos sin conos ni bastones que padecen trastornos de los fotorreceptores de conos y bastones. [9] El trabajo de Farhan H. Zaidi y sus colegas demostró que las células ganglionares fotorreceptivas pueden tener alguna función visual en los humanos.
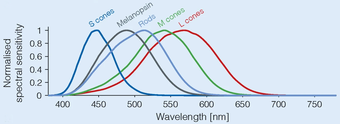
El fotopigmento de las células ganglionares fotorreceptivas, la melanopsina, se excita con la luz principalmente en la porción azul del espectro visible (la absorción alcanza un máximo de ~480 nanómetros [10] ). El mecanismo de fototransducción en estas células no se comprende completamente, pero parece probable que se parezca al de los fotorreceptores rabdoméricos de invertebrados . Además de responder directamente a la luz, estas células pueden recibir influencias excitadoras e inhibidoras de bastones y conos a través de conexiones sinápticas en la retina.
Los axones de estos ganglios inervan regiones del cerebro relacionadas con el reconocimiento de objetos, incluido el colículo superior y el núcleo geniculado lateral dorsal . [8]
Estas células fotorreceptoras se proyectan tanto por toda la retina como hacia el cerebro. Contienen el fotopigmento melanopsina en cantidades variables a lo largo de la membrana celular, incluso en los axones hasta el disco óptico, el soma y las dendritas de la célula. [3] Los ipRGC contienen receptores de membrana para los neurotransmisores glutamato, glicina y GABA . [11] Las células ganglionares fotosensibles responden a la luz despolarizándose, aumentando así la velocidad a la que disparan impulsos nerviosos, que es opuesta a la de otras células fotorreceptoras, que se hiperpolarizan en respuesta a la luz. [12]
Los resultados de estudios en ratones sugieren que los axones de los ipRGC no están mielinizados . [3]
A diferencia de otros pigmentos fotorreceptores, la melanopsina tiene la capacidad de actuar como fotopigmento excitable y como fotoisomerasa. A diferencia de las opsinas visuales en los bastones y los conos , que dependen de los ciclos visuales estándar para recargar todo trans- retinal nuevamente en el fotosensible 11-cis -retinal , la melanopsina es capaz de isomerizar todo trans- retinal en 11-cis-retinal. propia retina cuando se estimula con otro fotón. [11] Por lo tanto, un ipRGC no depende de las células de Müller y/o de las células del epitelio pigmentario de la retina para esta conversión.
Las dos isoformas de melanopsina difieren en su sensibilidad espectral, ya que la isoforma 11-cis -retinal responde mejor a longitudes de onda de luz más cortas, mientras que la isoforma totalmente trans responde mejor a longitudes de onda de luz más largas. [13]

Las ipRGC son presinápticas y postsinápticas para las células amacrinas dopaminérgicas (células DA) a través de sinapsis recíprocas, con las ipRGC enviando señales excitadoras a las células DA y las células DA enviando señales inhibidoras a las ipRGC. Estas señales inhibidoras están mediadas por GABA , que se libera conjuntamente desde las células DA junto con la dopamina . La dopamina tiene funciones en el proceso de adaptación a la luz al regular positivamente la transcripción de melanopsina en los ipRGC y, por lo tanto, aumentar la sensibilidad del fotorreceptor. [3] En paralelo con la inhibición de las células amacrinas DA, las células amacrinas liberadoras de somatostatina, a su vez inhibidas por las células amacrinas DA, inhiben las ipRGC. [14] Otras entradas sinápticas a las dendritas ipRGC incluyen células bipolares de cono y células bipolares de bastón. [11]
Un objetivo postsináptico de los ipRGC es el núcleo supraquiasmático (SCN) del hipotálamo, que sirve como reloj circadiano en un organismo. Los ipRGC liberan tanto la proteína activadora de adenilil ciclasa pituitaria (PACAP) como glutamato en el SCN a través de una conexión monosináptica llamada tracto retinohipotalámico (RHT). [15] El glutamato tiene un efecto excitador en las neuronas del SCN y PACAP parece mejorar los efectos del glutamato en el hipotálamo. [dieciséis]
Otros objetivos postsinápticos de los ipRGC incluyen: la valva intergenticulada (IGL), un grupo de neuronas ubicadas en el tálamo, que desempeñan un papel en el arrastre circadiano; el núcleo pretectal olivar (OPN), un grupo de neuronas en el mesencéfalo que controla el reflejo pupilar a la luz; el núcleo preóptico ventrolateral (VLPO), ubicado en el hipotálamo y es un centro de control del sueño; así como para [ aclarar ] la amígdala. [3]
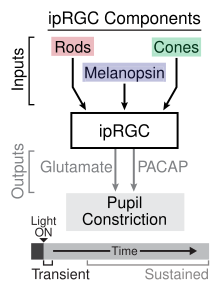
Utilizando varios ratones con fotorreceptores desactivados, los investigadores han identificado el papel de los ipRGC en la señalización tanto transitoria como sostenida del reflejo pupilar a la luz (PLR). [17] La PLR transitoria ocurre con intensidades de luz tenues a moderadas y es el resultado de la fototransducción que ocurre en los bastones , que proporcionan información sináptica a los ipRGC, que a su vez transmiten la información al núcleo pretectal olivar en el mesencéfalo . [18] El neurotransmisor implicado en la transmisión de información al mesencéfalo desde los ipRGC en el PLR transitorio es el glutamato . A intensidades de luz más brillantes se produce la PLR sostenida, que implica tanto la fototransducción de la varilla que proporciona información a los ipRGC como la fototransducción de los propios ipRGC a través de la melanopsina. Los investigadores han sugerido que el papel de la melanopsina en la PLR sostenida se debe a su falta de adaptación a los estímulos luminosos, a diferencia de los bastones, que muestran adaptación. El PLR sostenido se mantiene mediante la liberación de PACAP de los ipRGC de forma pulsátil. [17]
Los experimentos con seres humanos sin conos y sin bastones permitieron estudiar otra posible función del receptor. En 2007, se descubrió una nueva función para las células ganglionares fotorreceptivas. Zaidi y sus colegas demostraron que en los seres humanos el fotorreceptor de las células ganglionares de la retina contribuye a la visión consciente , así como a funciones que no forman imágenes, como los ritmos circadianos, el comportamiento y las reacciones pupilares. [9] Dado que estas células responden principalmente a la luz azul , se ha sugerido que tienen un papel en la visión mesópica [ cita necesaria ] y que la antigua teoría de una retina puramente dúplex con visión de luz de bastón (oscura) y cono (clara) era simplista. Por lo tanto, el trabajo de Zaidi y sus colegas con sujetos humanos sin conos y sin varillas también ha abierto la puerta a funciones de formación de imágenes (visuales) para el fotorreceptor de células ganglionares.
Se descubrió que existen vías de visión paralelas: una clásica basada en bastones y conos que surge de la retina exterior, y la otra, un rudimentario detector de brillo visual que surge de la retina interior. Este último parece ser activado por la luz antes que el primero. [9] Los fotorreceptores clásicos también se alimentan del novedoso sistema de fotorreceptores, y la constancia del color puede desempeñar un papel importante, como sugiere Foster [ cita requerida ] .
Los autores del modelo humano sin conos y sin bastones han sugerido que el receptor podría ser fundamental para comprender muchas enfermedades, incluidas las principales causas de ceguera en todo el mundo, como el glaucoma , una enfermedad que afecta a las células ganglionares.
En otros mamíferos, se ha demostrado que los ganglios fotosensibles desempeñan un papel genuino en la visión consciente. Pruebas realizadas por Jennifer Ecker et al. descubrieron que las ratas que carecían de bastones y conos podían aprender a nadar hacia secuencias de barras verticales en lugar de una pantalla gris igualmente luminiscente. [8]
La mayoría de los trabajos sugieren que la sensibilidad espectral máxima del receptor está entre 460 y 484 nm. Lockley et al. en 2003 [19] demostró que las longitudes de onda de luz de 460 nm (azul) suprimen la melatonina el doble que la luz de 555 nm (verde), la sensibilidad máxima del sistema visual fotópico. En el trabajo de Zaidi, Lockley y sus coautores utilizando un ser humano sin cono y sin varilla, se descubrió que un estímulo muy intenso de 481 nm conducía a cierta percepción consciente de la luz, lo que significa que se realizaba alguna visión rudimentaria. [9]
En 1923, Clyde E. Keeler observó que las pupilas de los ojos de ratones ciegos que había criado accidentalmente todavía respondían a la luz. [2] La capacidad de los ratones sin conos y sin bastones para retener un reflejo pupilar a la luz sugería la presencia de una célula fotorreceptora adicional. [11]
En la década de 1980, una investigación en ratas con deficiencia de conos y bastones mostró la regulación de la dopamina en la retina, un conocido neuromodulador para la adaptación a la luz y el fotoentrenamiento. [3]
La investigación continuó en 1991, cuando Russell G. Foster y sus colegas, incluido Ignacio Provencio , demostraron que los bastones y los conos no eran necesarios para el fotoentrenamiento, el impulso visual del ritmo circadiano , ni para la regulación de la secreción de melatonina de la glándula pineal , a través de los bastones. - y ratones knockout para conos. [20] [11] Un trabajo posterior de Provencio y colegas demostró que esta fotorespuesta estaba mediada por el fotopigmento melanopsina , presente en la capa de células ganglionares de la retina. [21]
Los fotorreceptores fueron identificados en 2002 por Samer Hattar , David Berson y sus colegas, donde se demostró que eran células ganglionares que expresaban melanopsina y que poseían una respuesta luminosa intrínseca y se proyectaban a varias áreas del cerebro involucradas en la visión sin formación de imágenes. [22] [23]
En 2005, Panda, Melyan, Qiu y sus colegas demostraron que el fotopigmento de melanopsina era el pigmento de fototransducción en las células ganglionares. [24] [25] Dennis Dacey y sus colegas demostraron en una especie de mono del Viejo Mundo que las células ganglionares gigantes que expresan melanopsina se proyectaban hacia el núcleo geniculado lateral (LGN). [26] [6] Anteriormente sólo se habían mostrado proyecciones al mesencéfalo (núcleo pretectal) y al hipotálamo ( núcleos supraquiasmáticos , SCN). Sin embargo, todavía no se sospechaba ni se había demostrado el papel visual del receptor.
Se intentó localizar el receptor en humanos, pero los humanos plantearon desafíos especiales y exigieron un nuevo modelo. A diferencia de otros animales, los investigadores no pudieron inducir éticamente la pérdida de conos y bastones, ni genéticamente ni con productos químicos, para estudiar directamente las células ganglionares. Durante muchos años, sobre el receptor en humanos sólo se podían hacer inferencias, aunque en ocasiones eran pertinentes.
En 2007, Zaidi y sus colegas publicaron su trabajo sobre humanos sin conos y sin varillas, demostrando que estas personas conservan respuestas normales a los efectos no visuales de la luz. [9] [27] Se descubrió que la identidad del fotorreceptor sin bastones ni conos en humanos es una célula ganglionar en la retina interna, como se mostró anteriormente en modelos sin bastones ni conos en algunos otros mamíferos. El trabajo se realizó utilizando pacientes con enfermedades raras que eliminaron la función clásica de los fotorreceptores de conos y bastones pero preservaron la función de las células ganglionares. [9] [27] A pesar de no tener bastones ni conos, los pacientes continuaron exhibiendo fotoentrenamiento circadiano, patrones de comportamiento circadiano, supresión de melatonina y reacciones pupilares, con sensibilidades espectrales máximas a la luz ambiental y experimental que coinciden con el fotopigmento de melanopsina. Sus cerebros también podrían asociar la visión con luz de esta frecuencia. Los médicos y científicos ahora intentan comprender el papel del nuevo receptor en las enfermedades humanas y la ceguera. [ cita necesaria ] Las CGR intrínsecamente fotosensibles también se han implicado en la exacerbación del dolor de cabeza por la luz durante los ataques de migraña. [28]