.jpg/440px-Human_Cerebral_Organoids_(53728295930).jpg)
Un organoide neuronal o cerebral describe un tejido cultivado artificialmente, in vitro , que se asemeja a partes del cerebro humano . Los organoides neuronales se crean cultivando células madre pluripotentes en un cultivo tridimensional que se puede mantener durante años. [1] [2] El cerebro es un sistema extremadamente complejo de tejidos heterogéneos y consta de una variedad diversa de neuronas y células gliales . Esta complejidad ha hecho que estudiar el cerebro y comprender cómo funciona sea una tarea difícil en neurociencia, especialmente cuando se trata de enfermedades neurodegenerativas y del desarrollo neurológico. El propósito de crear un modelo neurológico in vitro es estudiar estas enfermedades en un entorno más definido. Este modelo 3D está libre de muchas limitaciones potenciales in vivo . La fisiología variable entre los modelos humanos y otros mamíferos limita el alcance de los estudios animales en trastornos neurológicos. Los organoides neuronales contienen varios tipos de células nerviosas y tienen características anatómicas que recapitulan regiones del sistema nervioso. [3] Algunos organoides neuronales son más similares a las neuronas de la corteza . En algunos casos, la retina , la médula espinal , el tálamo y el hipocampo . [1] Otros organoides neuronales no están guiados y contienen una diversidad de células neuronales y no neuronales. Las células madre tienen el potencial de convertirse en muchos tipos diferentes de tejidos, y su destino depende de muchos factores. A continuación se muestra una imagen que muestra algunos de los factores químicos que pueden llevar a las células madre a diferenciarse en varios tejidos neuronales; se ha publicado una tabla más detallada sobre la generación de identidades específicas de organoides. [3] Se utilizan técnicas similares en células madre utilizadas para hacer crecer organoides cerebrales. [3]

El uso de células madre pluripotentes humanas para crear organoides neuronales in vitro permite a los investigadores analizar los mecanismos de desarrollo actuales del tejido neuronal humano, así como estudiar las raíces de las enfermedades neurológicas humanas. Los organoides neuronales son una herramienta de investigación que se utiliza para comprender cómo funciona la patología de las enfermedades. Estos organoides se pueden utilizar en experimentos para los que los métodos in vitro actuales son demasiado simplistas, al mismo tiempo que son más aplicables a los seres humanos que los modelos de roedores u otros mamíferos. Históricamente, los principales avances en el funcionamiento del cerebro han sido el resultado del estudio de lesiones o trastornos en la función cerebral humana. Un modelo de cerebro humano in vitro permite la siguiente ola en nuestra comprensión del sistema nervioso humano. [1]
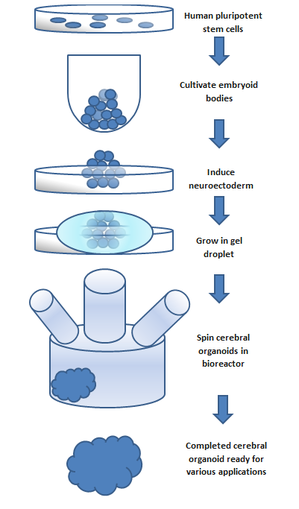
Un cuerpo embrionario cultivado a partir de células madre pluripotentes se utiliza para crear un organoide . Los cuerpos embrionarios están compuestos por tres capas: endodermo , mesodermo y ectodermo , que tienen el potencial de diferenciarse en diferentes tipos de tejido.
Un organoide cerebral se puede formar induciendo a las células del ectodermo a diferenciarse en un organoides cerebral. [4] El procedimiento general se puede dividir en 5 pasos. [1] [5] Primero se cultivan células madre pluripotentes humanas. Luego se cultivan en un cuerpo embrionario . A continuación, se induce el cultivo celular para formar un neuroectodermo . Luego, el neuroectodermo se cultiva en una gota de matrigel . El matrigel proporciona nutrientes y el neuroectodermo comienza a proliferar y crecer. La replicación de regiones cerebrales específicas en contrapartes organoides cerebrales se logra mediante la adición de señales extracelulares al entorno organoides durante diferentes etapas de desarrollo; se encontró que estas señales crean cambios en los patrones de diferenciación celular, lo que conduce a la recapitulación de la región cerebral deseada. [3] La inhibición de SMAD se puede utilizar en procesos habituales de cultivo de organoides cerebrales para generar microglia en organoides cerebrales. [6] La falta de vasculatura limita el tamaño que puede crecer el organoide. Esta ha sido la principal limitación en el desarrollo de organoides. El uso de un biorreactor giratorio puede mejorar la disponibilidad de nutrientes para las células dentro del organoide para mejorar el desarrollo del organoide. [7] Los biorreactores giratorios se han utilizado cada vez más en aplicaciones de cultivo celular y crecimiento de tejidos. El reactor puede ofrecer tiempos de duplicación celular más rápidos , mayor expansión celular y mayores componentes de la matriz extracelular en comparación con las células cultivadas estáticamente. [8]
Se ha demostrado que los organoides cerebrales cultivados mediante el método de cultivo 3D con biorreactor giratorio se diferencian en varios tipos de tejido neuronal, como la copa óptica, el hipocampo, las partes ventrales del teleencéfalo y la corteza dorsal. [9] Además, se demostró que los organoides cerebrales humanos podrían desarrollar intrínsecamente copas ópticas fotosensibles integradas. [10]
Las células madre/progenitoras neuronales son únicas porque pueden autorenovarse y son multipotentes. Esto significa que pueden generar neuronas y células gliales, que son los dos componentes principales de los sistemas neuronales. El destino de estas células está controlado por varios factores que afectan el proceso de diferenciación. La ubicación espacial y los atributos temporales de las células progenitoras neuronales pueden influir en si las células forman neuronas o células gliales. La diferenciación posterior está controlada por las condiciones extracelulares y la señalización celular. [11] Se desconocen las condiciones y los estímulos exactos necesarios para diferenciar las células progenitoras neuronales en tejidos neuronales específicos, como el tejido hipocampal, el nervio óptico, la corteza cerebral, etc. Se cree que los organoides cerebrales pueden usarse para estudiar los mecanismos de desarrollo de estos procesos. [7]
Para comprobar si las células progenitoras neuronales y las células madre se están diferenciando en tejidos neuronales específicos, se pueden probar varios marcadores genéticos. Dos marcadores que están presentes durante las etapas pluripotentes son OCT4 y NANOG . Estos dos marcadores disminuyen durante el curso del desarrollo del organoide. Los marcadores de identidad neuronal que notan una inducción neuronal exitosa, SOX1 y PAX6 , se regulan positivamente durante el desarrollo del organoide. Estos cambios en la expresión respaldan el caso de la diferenciación autoguiada de los organoides cerebrales. [1] También se pueden probar los marcadores del prosencéfalo y el rombencéfalo. Los marcadores del prosencéfalo FOXG1 y SIX3 se expresan en gran medida durante el desarrollo del organoide. Sin embargo, los marcadores del rombencéfalo EGR2 e ISL1 muestran una presencia temprana pero una disminución en las etapas posteriores. Este desequilibrio hacia el desarrollo del prosencéfalo es similar a la expansión del desarrollo del tejido del prosencéfalo en el desarrollo del cerebro humano. [1] Para probar si los organoides se desarrollan aún más en la especificación regional, se han probado marcadores genéticos para la corteza cerebral y el lóbulo occipital . Muchas regiones que tienen el marcador del prosencéfalo FOXG1 , etiquetándolas como regiones con morfología cortical cerebral, también fueron positivas para el marcador EMX1 que indica identidad cortical dorsal. Estas regiones específicas pueden especificarse aún más mediante los marcadores AUTS2 , TSHZ2 y LMO4 , donde el primero representa la corteza cerebral y los dos siguientes representan el lóbulo occipital. [1] Los marcadores genéticos para el hipocampo, el prosencéfalo ventral y el plexo coroideo también están presentes en los organoides cerebrales, sin embargo, las estructuras generales de estas regiones aún no se han formado.
Los organoides cerebrales también poseen neuronas corticales cerebrales funcionales. Estas neuronas deben formarse en la placa cortical organizada radialmente. El marcador TBR1 está presente en la preplaca, el precursor de la placa cortical, y está presente, junto con MAP2 , un marcador neuronal, en organoides cerebrales de 30 días. Estos marcadores son indicativos de una capa neural basal similar a una preplaca. Estas células también están adyacentes apicalmente a una zona neutral y son reelina + positivas, lo que indica la presencia de células de Cajal-Retzius. Las células de Cajal-Retzius son importantes para la generación de la arquitectura de la placa cortical. [7] La placa cortical generalmente se genera de adentro hacia afuera, de modo que las neuronas que nacen más tarde migran a las capas superficiales superiores. Esta organización también está presente en organoides cerebrales según pruebas de marcadores genéticos. Las neuronas que nacen temprano tienen el marcador CTIP2 y están ubicadas adyacentes a las células de la preplaca que exhiben TBR1. Las neuronas de nacimiento tardío con los marcadores SATB2 y BRN2 se encuentran en una capa superficial, más alejadas de la preplaca que las neuronas de nacimiento temprano, lo que sugiere la formación de una capa de placa cortical. Además, después de 75 días de formación, los organoides cerebrales muestran una zona marginal rudimentaria, una región pobre en células. La formación de una placa cortical en capas es muy básica en los organoides cerebrales y sugiere que el organoide carece de las señales y los factores para inducir la formación de la organización de las capas II-VI. [1] Sin embargo, las neuronas organoides cerebrales pueden formar axones, como se muestra mediante la tinción con GFP . Se ha demostrado que los axones marcados con GFP tienen una ramificación compleja y la formación de conos de crecimiento. Además, la obtención de imágenes con colorante de calcio ha demostrado que los organoides cerebrales tienen oscilaciones de Ca 2+ y picos espontáneos de calcio en células individuales. La señalización de calcio se puede mejorar a través del glutamato e inhibir a través de la tetrodotoxina . [1]
En DishBrain , se integraron células cerebrales humanas cultivadas en sistemas digitales para jugar un Pong simulado mediante estimulación y registro electrofisiológico. Las células "mostraron un rendimiento significativamente mejorado en Pong " cuando se incorporaron a un mundo de juego virtual. [12] [13] [14] En la década de 2020, cambios significativos en la forma en que se crean estos sistemas electrofisiológicos e interactúan con los organoides cerebrales podrían conducir a una mejor estimulación y registro de datos en todo el organoindo en 3D. [15]
No se entiende completamente cómo los tejidos localizados individuales formados por células madre pueden coordinarse con los tejidos circundantes para desarrollarse en un órgano completo. [16] Sin embargo, se ha demostrado que la mayor parte de la diferenciación tisular requiere interacciones con los tejidos circundantes y depende de factores de inducción difusibles para inhibir o estimular diversas diferenciaciones y localización física. [16] La diferenciación de organoides cerebrales está algo localizada. Los marcadores mencionados anteriormente para el prosencéfalo y el rombencéfalo están físicamente localizados y aparecen en grupos. Esto sugiere que los estímulos locales se liberan una vez que una o más células se diferencian en un tipo específico en lugar de una vía aleatoria en todo el tejido. Los marcadores para la subespecificación de los lóbulos corticales, la corteza prefrontal y el lóbulo occipital, también están físicamente localizados. Sin embargo, las células del hipocampo y del prosencéfalo ventral no están físicamente localizadas y se ubican aleatoriamente a través del organoide cerebral. [1] Los organoides cerebrales carecen de vasos sanguíneos y su tamaño está limitado por la absorción de nutrientes en las células más internas. Los biorreactores giratorios y las técnicas avanzadas de andamiaje 3D pueden aumentar el tamaño de los organoides, aunque es probable que la integración de sistemas de suministro de nutrientes in vitro desencadene el próximo gran salto en el desarrollo de organoides cerebrales. [17]
Los organoides cerebrales tienen el potencial de funcionar como un modelo con el que se pueden estudiar las enfermedades y la expresión genética. [18] Sin embargo, se necesitan herramientas de diagnóstico para evaluar el tejido organoides cerebrales y crear organoides que modelen la enfermedad o el estado de desarrollo en cuestión. [19] El análisis del transcriptoma se ha utilizado como un ensayo para examinar la patología de los organoides cerebrales derivados de pacientes individuales. [20] Además, los ensayos TUNEL se han utilizado en estudios como un marcador evaluativo de la apoptosis en organoides cerebrales. [21] Otros ensayos utilizados para analizar organoides cerebrales incluyen los siguientes:
Los organoides cerebrales se pueden utilizar para estudiar la expresión genética a través de modificaciones genéticas. [18] El grado en que estas modificaciones genéticas están presentes en todo el organoide depende de la etapa de desarrollo en la que se encuentre el organoide cerebral cuando se realizan estas modificaciones genéticas; cuanto antes se realicen estas modificaciones, como cuando el organoide cerebral está en la etapa de célula única, es más probable que estas modificaciones afecten a una mayor porción de las células en el organoide cerebral. [18] El grado en que estas modificaciones genéticas están presentes dentro del organoide cerebral también depende del proceso por el cual se realizan estas modificaciones genéticas. Si la información genética se administra en el genoma de una célula organoide cerebral a través de maquinaria, entonces la modificación genética permanecerá presente en las células resultantes de la replicación. [18] Crispr/Cas 9 es un método por el cual se puede realizar esta modificación genética de larga duración. [18] También se ha sugerido un sistema que implica el uso de transposones como un medio para generar modificaciones genéticas de larga duración; Sin embargo, el grado en el que los transposones pueden interactuar con el genoma de una célula puede diferir de una célula a otra, lo que crearía una expresividad variable entre las células organoides cerebrales. [18] Sin embargo, si la modificación genética se realiza mediante la inserción de una “carga genética” (como por ejemplo mediante métodos de electroporación / virus adenoasociados ), se ha descubierto que la modificación genética se vuelve menos presente con cada ronda de división celular en los organoides cerebrales. [18]
Se ha solicitado el uso de métodos computacionales como un medio para ayudar a mejorar el proceso de cultivo de organoides cerebrales; también se ha solicitado el desarrollo de métodos computacionales para proporcionar representaciones detalladas necesarias de diferentes componentes del organoides cerebral (como la conectividad celular) que los métodos actuales no pueden proporcionar. [19] Todavía no existe una programación diseñada para modelar la morfología detallada de los organoides cerebrales. [19]
Existen muchas aplicaciones potenciales para el uso de organoides cerebrales, como el potencial destino celular , la terapia de reemplazo celular y los ensayos genómicos específicos de cada tipo de célula. [17] Los organoides cerebrales también proporcionan una perspectiva única sobre el momento del desarrollo de los tejidos neuronales y se pueden utilizar como una herramienta para estudiar las diferencias entre especies. [17] Otras aplicaciones potenciales para los organoides cerebrales incluyen: [17]
La morfogénesis tisular en relación con los organoides cerebrales abarca la forma en que se forman los órganos neuronales en los vertebrados . Los organoides cerebrales pueden servir como herramientas in vitro para estudiar la formación, modularla y comprender mejor los mecanismos que la controlan. [17]
Los organoides cerebrales pueden ayudar a estudiar la migración celular . Las células gliales neuronales abarcan una amplia variedad de células neuronales, algunas de las cuales se mueven alrededor de las neuronas. Los factores que rigen sus movimientos, así como los de las neuronas en general, pueden estudiarse mediante organoides cerebrales. [4]
El rastreo de linaje clonal es parte del mapeo del destino , donde el linaje de los tejidos diferenciados se rastrea hasta los progenitores pluripotentes. Los estímulos locales liberados y el mecanismo de diferenciación se pueden estudiar utilizando organoides cerebrales como modelo. [17] Las modificaciones genéticas en organoides cerebrales podrían servir como un medio para lograr el rastreo de linaje. [18]
Los organoides cerebrales se pueden utilizar para hacer crecer regiones cerebrales específicas y trasplantarlas a regiones de neurodegeneración como tratamiento terapéutico. [22] [23] Pueden fusionarse con la vasculatura del huésped y ser inmunológicamente silenciosos. [24] En algunos casos, primero habría que editar los genomas de estos organoides cerebrales. [20] Estudios recientes han podido lograr un trasplante e integración exitosos de organoides cerebrales en cerebros de ratones; también se observó el desarrollo de la diferenciación celular y la vascularidad después del trasplante. [25] Los organoides cerebrales podrían servir como base para el trasplante y la reconstrucción en el cerebro humano debido a la similitud en la estructura. [25]
Los organoides cerebrales pueden utilizarse como modelos simples de tejidos cerebrales complejos para estudiar los efectos de los fármacos y evaluar su seguridad y eficacia iniciales. Este método de aplicación de métodos de detección de alto rendimiento de fármacos a los organoides cerebrales también podría permitir probar nuevos fármacos para enfermedades neurológicas. [20] Después de 2015, se han hecho importantes esfuerzos para fabricar dispositivos a microescala para generar organoides cerebrales reproducibles a alto rendimiento. [15]
Los organoides se pueden utilizar para el estudio del desarrollo del cerebro , por ejemplo, para identificar e investigar interruptores genéticos que tienen un impacto significativo en él. [26] [27] [28] Esto se puede utilizar para la prevención y el tratamiento de enfermedades específicas [29] (ver más abajo), pero también para otros fines, como conocimientos sobre los factores genéticos de la evolución reciente del cerebro (o el origen de los humanos y la diferencia evolucionada con otros simios), [30] [31] [32] la mejora humana y la mejora de la inteligencia , la identificación de los impactos perjudiciales del exposoma (y su protección) o la mejora de la salud cerebral .
Los organoides pueden utilizarse para estudiar las etapas iniciales cruciales del desarrollo cerebral, probar fármacos y, dado que pueden fabricarse a partir de células vivas, estudiar pacientes individuales. [33] Además, el desarrollo de organoides cerebrales vascularizados podría utilizarse para investigar la terapia contra los accidentes cerebrovasculares en el futuro. [34]
Se ha demostrado que el virus del Zika tiene efectos teratogénicos, causando defectos en el desarrollo neurológico fetal. Los organoides cerebrales se han utilizado en estudios para comprender el proceso por el cual el virus del Zika afecta el cerebro fetal y, en algunos casos, causa microcefalia. [20] [21] Se ha descubierto que los organoides cerebrales infectados con el virus del Zika son más pequeños que sus contrapartes no infectadas, lo que refleja la microcefalia fetal. [20] [21] También se encontró un aumento de la apoptosis en los organoides cerebrales infectados con el virus del Zika. [35] Otro estudio encontró que las poblaciones de células progenitoras neuronales (NPC) se redujeron en gran medida en estas muestras. Los dos métodos por los cuales se redujeron las poblaciones de NPC fueron el aumento de la muerte celular y la reducción de la proliferación celular. Se identificó la regulación positiva del receptor TLR3 en estos organoides infectados. Se demostró que la inhibición de este receptor TLR3 detiene parcialmente algunos de los efectos inducidos por el Zika. [36] Además, se encontró que el tamaño del lumen aumentó en los organoides infectados con el virus del Zika. [20] [21] Los resultados encontrados al estudiar organoides cerebrales infectados con el virus Zika en diferentes etapas de maduración sugieren que la exposición temprana en fetos en desarrollo puede causar una mayor probabilidad de defectos de nacimiento neurológicos asociados al virus Zika. [21]
También se ha demostrado que la cocaína tiene efectos teratogénicos en el desarrollo fetal. Se han utilizado organoides cerebrales para estudiar qué isoformas enzimáticas son necesarias para los defectos neurológicos fetales causados por el consumo de cocaína durante el embarazo. [20] Se determinó que una de estas enzimas era la isoforma CYP3A5 del citocromo P450 . [20]
En un caso, un organoide cerebral cultivado a partir de un paciente con microcefalia mostró síntomas relacionados y reveló que, aparentemente, la causa es un desarrollo demasiado rápido, seguido de un crecimiento cerebral más lento. La microcefalia es una afección del desarrollo en la que el cerebro permanece de tamaño insuficiente, lo que produce una cabeza de tamaño insuficiente y debilitamiento. La microcefalia no es adecuada para modelos de ratón, que no replican la afección. [33] Se cree que la forma primaria de la enfermedad es causada por una mutación homocigótica en el gen de la microcefalina . La enfermedad es difícil de reproducir en modelos de ratón porque los ratones carecen de las etapas de desarrollo para una corteza cerebral agrandada que tienen los humanos. Naturalmente, una enfermedad que afecta a este desarrollo sería imposible de mostrar en un modelo que no lo tiene para empezar. [37] Para utilizar organoides cerebrales para modelar la microcefalia de un humano, un grupo de investigadores ha tomado fibroblastos de la piel del paciente y los ha reprogramado utilizando cuatro factores de reprogramación bien conocidos. Estos incluyen OCT4 , SOX2 , MYC y KLF4 . La muestra reprogramada se pudo clonar en células madre pluripotentes inducidas. Las células se cultivaron en un organoide cerebral siguiendo un proceso descrito en la sección de creación de organoide cerebral a continuación. El organoide resultante tenía una cantidad reducida de células progenitoras neuronales y tejidos más pequeños. Además, los tejidos derivados del paciente mostraron menos y menos frecuentes tejidos neuroepiteliales compuestos por progenitores, una disminución de las células madre gliales radiales y un aumento de las neuronas. Estos resultados sugieren que el mecanismo subyacente de la microcefalia es causado por células que se diferencian prematuramente en neuronas, lo que deja un déficit de células gliales radiales. [1]
La patología de la enfermedad de Alzheimer también se ha modelado con organoides cerebrales. [38] Las células madre pluripotentes de los individuos afectados se utilizaron para generar organoides cerebrales y luego se compararon con modelos de control, sintetizados a partir de individuos sanos. Se encontró que en los modelos afectados, se observaron estructuras similares a las de las placas causadas por las proteínas beta amiloide y los ovillos neurofibrilares , que causan los síntomas de la enfermedad. [39] Los intentos anteriores de modelar esto con tanta precisión no han tenido éxito, y se han desarrollado medicamentos sobre la base de la eficacia en modelos murinos preclínicos que no demostraron ningún efecto en los ensayos humanos. [40]
Los organoides cerebrales también se pueden utilizar para estudiar los trastornos del espectro autista. [41] En un estudio, se cultivaron organoides cerebrales a partir de células derivadas de pacientes con TEA y macrocefalia. [41] Se descubrió que estos organoides cerebrales reflejaban características típicas del fenotipo de macrocefalia relacionado con el TEA que se encontró en los pacientes. [41] Al cultivar organoides cerebrales de pacientes con TEA y macrocefalia, se pudieron establecer conexiones entre ciertas mutaciones genéticas y la expresión fenotípica. [41] El autismo también se ha estudiado mediante la comparación de organoides cerebrales sintetizados sanos frente a afectados. [42] La observación de los dos modelos mostró la sobreexpresión de un factor de transcripción FOXG1 que produjo una mayor cantidad de neuronas inhibidoras GABAérgicas en los modelos afectados. La importancia de este uso de organoides cerebrales es que ha agregado un gran apoyo a la hipótesis del desequilibrio excitatorio/inhibitorio [43] que, si se demuestra que es cierta, podría ayudar a identificar objetivos para los medicamentos para poder tratar la afección.
El campo de la epigenética y la forma en que la metilación del ADN puede influir en el desarrollo del TEA también ha sido de interés en los últimos años. El método tradicional de estudiar muestras neuronales post mortem de individuos con TEA plantea muchos desafíos, por lo que se han propuesto los organoides cerebrales como un método alternativo para estudiar el efecto potencial que los mecanismos epigenéticos pueden tener en el desarrollo del autismo. Este uso del modelo de organoides cerebrales para examinar el TEA y los patrones epigenéticos podría proporcionar información sobre las líneas de tiempo del desarrollo epigenético. Sin embargo, es importante señalar que las condiciones en las que se cultivan los organoides cerebrales podrían afectar la expresión genética y, en consecuencia, afectar las observaciones realizadas utilizando este modelo. Además, existe preocupación por la variabilidad en los organoides cerebrales cultivados a partir de la misma muestra. [44] También se necesita más investigación sobre el grado y la precisión con que los organoides cerebrales recapitulan los patrones epigenéticos encontrados en muestras primarias. [44]
Las lesiones hipóxicas prematuras siguen siendo difíciles de estudiar debido a la disponibilidad limitada de tejidos cerebrales fetales humanos y a la insuficiencia de modelos animales para estudiar la corticogénesis humana. Los organoides cerebrales se pueden utilizar para modelar la fisiopatología prenatal y comparar la susceptibilidad de los diferentes tipos de células neuronales a la hipoxia durante la corticogénesis. Los progenitores intermedios parecen verse particularmente afectados, debido a la vía de respuesta de la proteína desplegada. [45] También se ha observado que la hipoxia dio lugar a la apoptosis en los organoides cerebrales, siendo especialmente afectados la glía radial externa y los neuroblastos/neuronas inmaduras. [46]
Los métodos tradicionales para estudiar los glioblastomas tienen limitaciones, como por ejemplo la disponibilidad limitada de muestras. Debido a estos desafíos que conlleva el uso de un enfoque más tradicional, los organoides cerebrales se han utilizado como un medio alternativo para modelar el desarrollo del cáncer cerebral. En un estudio, se simularon organoides cerebrales para reflejar cualidades similares a las de un tumor utilizando CRISPR CAS-9. Se observó un aumento de la división celular en estos modelos genéticamente alterados. También se utilizaron organoides cerebrales en modelos de ratones para estudiar la tumorogénesis y la invasividad. Al mismo tiempo, el crecimiento de los cánceres cerebrales está influenciado por factores ambientales que aún no son replicables en modelos de organoides cerebrales. Se ha demostrado que los organoides cerebrales brindan información sobre la desregulación de los genes responsables del desarrollo de tumores. [35]
La esclerosis múltiple es un trastorno inflamatorio autoinmunitario que afecta al sistema nervioso central. Los factores ambientales y genéticos contribuyen al desarrollo de la esclerosis múltiple, sin embargo, se desconoce la etiología de esta afección. Las células madre pluripotentes inducidas de controles humanos sanos, así como de pacientes con esclerosis múltiple, se cultivaron en organoides cerebrales para crear un modelo humano innovador de esta enfermedad. [47]
Los organoides cerebrales son preferibles a sus contrapartes de cultivos celulares en 3D porque pueden reflejar mejor la estructura del cerebro humano y porque, hasta cierto punto, pueden reflejar el desarrollo del neocórtex fetal durante un período prolongado de tiempo. Si bien los organoides cerebrales tienen mucho potencial, su cultivo y desarrollo tienen limitaciones y áreas de mejora. [35] Por ejemplo, se necesitan varios meses para crear un organoide cerebral y los métodos utilizados para analizarlos también requieren mucho tiempo. [25] Además, los organoides cerebrales no tienen estructuras típicas de un cerebro humano, como una barrera hematoencefálica. [35] Esto limita los tipos de enfermedades que se pueden estudiar. Otras limitaciones incluyen:
Hasta hace poco, se ha descubierto que la parte central de los organoides está necrótica debido a que el oxígeno y los nutrientes no pueden llegar a esa zona más interna. [34] [19] Esto impone limitaciones a la aplicabilidad fisiológica de los organoides cerebrales. [19] Debido a esta falta de oxígeno y nutrientes, las células progenitoras neuronales tienen un crecimiento limitado. [48] Sin embargo, hallazgos recientes sugieren que, en el proceso de cultivo de un organoide cerebral, se podría evitar un centro necrótico utilizando dispositivos fluídicos para aumentar la exposición del organoide a los medios. [19]
Se ha descubierto que la estructura de los organoides cerebrales en diferentes cultivos es variable; un procedimiento de estandarización para garantizar la uniformidad aún no se ha convertido en una práctica común. [34] Los pasos futuros en la revisión de la producción de organoides cerebrales incluirían la creación de métodos para garantizar la estandarización de la generación de organoides cerebrales. [34] Uno de esos pasos propuestos implica regular la composición y el espesor del gel en el que se cultivan los organoides cerebrales; esto podría contribuir a una mayor confiabilidad en la producción de organoides cerebrales. [19] Además, la variabilidad en la generación de organoides cerebrales se introduce debido a las diferencias en las células madre utilizadas. [20] Estas diferencias pueden surgir de diferentes métodos de fabricación o diferencias del anfitrión. [20] También se ha encontrado un mayor estrés metabólico dentro de los organoides. Se ha descubierto que este estrés metabólico restringe la especificidad de los organoides. [6] Los pasos futuros para agilizar el cultivo de organoides incluyen analizar más de una muestra a la vez. [25]
En la actualidad, el desarrollo de sinapsis maduras en organoides cerebrales está limitado debido a los medios utilizados. [34] Además, si bien se ha demostrado que algunas propiedades electrofisiológicas se desarrollan en organoides cerebrales, se ha demostrado que el cultivo de regiones organoides separadas y distintas limita la maduración de estas propiedades electrofisiológicas. El modelado de procesos de neurodesarrollo electrofisiológicos típicos del desarrollo posterior en la línea de tiempo del neurodesarrollo, como la sinaptogénesis , aún no se sugiere en modelos de organoides cerebrales. [6] Dado que los organoides cerebrales reflejan lo que sucede durante el neurodesarrollo fetal, ha habido preocupación sobre cómo se manifiestan en ellos las enfermedades de aparición tardía. Las mejoras futuras incluyen el desarrollo de una forma de recapitular las enfermedades neurodegenerativas en organoides cerebrales. [25]
Se han planteado preocupaciones éticas con el uso de organoides cerebrales como modelo para la enfermedad debido a la posibilidad de que experimenten sensaciones como el dolor o tengan la capacidad de desarrollar una conciencia . [49] Actualmente es poco probable dada la simplicidad de los modelos sintetizados en comparación con la complejidad de un cerebro humano; sin embargo, se ha demostrado que los modelos responden a la estimulación basada en la luz, [50] por lo que los modelos actuales tienen cierto alcance para responder a algunos estímulos.
Se están tomando medidas para resolver la zona gris, como un simposio de 2018 en la Universidad de Oxford, donde expertos en el campo, filósofos y abogados se reunieron para tratar de aclarar las preocupaciones éticas con la nueva tecnología. [51] De manera similar, proyectos como Brainstorm de la Case Western University tienen como objetivo observar el progreso del campo mediante el monitoreo de laboratorios que trabajan con organoides cerebrales para tratar de comenzar la "construcción de un marco filosófico" sobre el cual se puedan construir futuras pautas y legislación. [52]
Además, la "humanización" de los modelos animales se ha planteado como un tema de preocupación en el trasplante de organoides derivados de células madre humanas en otros modelos animales. [48] Por ejemplo, se describieron posibles preocupaciones futuras de este tipo cuando se trasplantaron organoides de tejido cerebral humano a ratas bebés , que parecían ser altamente funcionales, madurar e integrarse con el cerebro de la rata. Dichos modelos se pueden utilizar para modelar el desarrollo del cerebro humano y, como se ha demostrado, para investigar enfermedades (y sus posibles terapias), pero podrían ser controvertidos . [53] [54] [55]
Tabla 1: Protocolos para la generación de organoides cerebrales
{{cite journal}}: CS1 maint: URL no apta ( enlace )