La neomicina es un antibiótico aminoglucósido que muestra actividad bactericida contra bacilos aerobios gramnegativos y algunos bacilos anaerobios en los que aún no ha surgido resistencia. Por lo general, no es eficaz contra bacilos grampositivos y bacilos gramnegativos anaerobios. La neomicina viene en formulaciones orales y tópicas, que incluyen cremas, ungüentos y gotas para los ojos. La neomicina pertenece a la clase de antibióticos aminoglucósidos que contienen dos o más aminoazúcares conectados por enlaces glucosídicos .
La neomicina fue descubierta en 1949 por el microbiólogo Selman Waksman y su alumno Hubert Lechevalier en la Universidad Rutgers . La neomicina recibió la aprobación para uso médico en 1952. [1] La Universidad Rutgers obtuvo la patente para la neomicina en 1957. [2]
La neomicina fue descubierta en 1949 por el microbiólogo Selman Waksman y su alumno Hubert Lechevalier en la Universidad Rutgers . La produce de forma natural la bacteria Streptomyces fradiae . [3] La síntesis requiere condiciones específicas de nutrientes en condiciones aeróbicas estacionarias o sumergidas. Luego, el compuesto se aísla y se purifica a partir de la bacteria. [4]
La neomicina se aplica típicamente como una preparación tópica , como Neosporin ( neomicina/polimixina B/bacitracina ). El antibiótico también se puede administrar por vía oral, en cuyo caso se suele combinar con otros antibióticos. La neomicina no se absorbe en el tracto gastrointestinal y se ha utilizado como medida preventiva para la encefalopatía hepática y la hipercolesterolemia . Al matar las bacterias en el tracto intestinal, la neomicina mantiene bajos los niveles de amoníaco y previene la encefalopatía hepática, especialmente antes de una cirugía gastrointestinal . [ cita requerida ]
Waksman y Lechevalier observaron originalmente que la neomicina era activa contra las bacterias resistentes a la estreptomicina, así como contra Mycobacterium tuberculosis , el agente causal de la tuberculosis . [5] La neomicina también se ha utilizado para tratar el sobrecrecimiento bacteriano del intestino delgado . La neomicina no se administra mediante inyección, ya que es extremadamente nefrotóxica (dañina para la función renal) incluso en comparación con otros aminoglucósidos . La excepción es cuando se incluye neomicina, en pequeñas cantidades, como conservante en algunas vacunas, normalmente 25 μg por dosis. [6]
Al igual que otros aminoglucósidos, la neomicina tiene una excelente actividad contra las bacterias gramnegativas y es parcialmente eficaz contra las bacterias grampositivas . Es relativamente tóxica para los humanos y las reacciones alérgicas se han observado como una reacción adversa común (ver: hipersensibilidad ). [7] Los médicos a veces recomiendan usar ungüentos antibióticos sin neomicina, como Polysporin . [8] A continuación se presentan los datos de susceptibilidad de concentración inhibitoria mínima (CIM) para algunas bacterias gramnegativas de importancia médica. [9]
En 2005-06, la neomicina fue el quinto alérgeno más frecuente en los resultados de las pruebas de parche (10,0%). [10] Fue nombrado Alérgeno del Año en 2010. [11] La neomicina también es un conocido antagonista del ácido gamma -aminobutírico GABA y puede ser responsable de convulsiones y psicosis. [12] Al igual que otros aminoglucósidos, se ha demostrado que la neomicina es ototóxica , causando tinnitus , pérdida de audición y problemas vestibulares en una pequeña cantidad de pacientes. La neomicina afecta la cóclea, que se encuentra en el oído interno. [13] La pérdida de audición es causada por la muerte de las células ciliadas del oído, que ocurre en respuesta al tratamiento con neomicina. [13] Se recomienda a los pacientes con tinnitus o pérdida auditiva neurosensorial existentes que hablen con un médico sobre los riesgos y efectos secundarios antes de tomar este medicamento. [ cita requerida ]
La actividad antibacteriana de la neomicina proviene de su unión a la subunidad 30S del ribosoma procariota , donde inhibe la traducción procariota del ARNm. [14]
La neomicina también exhibe una alta afinidad de unión por el fosfatidilinositol 4,5-bisfosfato (PIP2), un componente fosfolípido de las membranas celulares. [15]
La resistencia a la neomicina es conferida por uno de los dos genes de la kanamicina quinasa . [16] Los genes que confieren resistencia a la neomicina se incluyen comúnmente en plásmidos de ADN utilizados para establecer líneas celulares estables de mamíferos que expresan proteínas clonadas en cultivo. Muchos plásmidos de expresión de proteínas disponibles comercialmente contienen un gen de neoresistencia como marcador seleccionable . Actualmente, se están realizando investigaciones para comprender si los derivados de la neomicina tienen los mismos efectos antibióticos y al mismo tiempo son efectivos contra las bacterias resistentes a la neomicina. [17]
La neomicina se aisló por primera vez de Streptomyces fradiae y Streptomyces albogriseus en 1949 (NBRC 12773). [18] La neomicina es una mezcla de neomicina B (framicetina); y su epímero neomicina C, el último componente representa alrededor del 5-15% de la mezcla. Es un compuesto básico que es más activo con una reacción alcalina. [5] También es termoestable y soluble en agua (mientras que es insoluble en solventes orgánicos). [5] La neomicina tiene buena actividad contra bacterias Gram-positivas y Gram-negativas , pero es ototóxica . Por lo tanto, su uso está restringido al tratamiento oral de infecciones intestinales. [19]
La neomicina B se compone de cuatro fracciones enlazadas: D -neosamina, 2-desoxiestreptamina (2-DOS), D -ribosa y L -neosamina. [ cita requerida ]
La neomicina A, también llamada neamina, contiene D -neosamina y 2-desoxiestreptamina. Seis genes son responsables de la biosíntesis de neamina: gen DOIS (btrC, neo7); gen de la aminotransferasa L-glutamina:DOI (btrS, neo6); un supuesto gen de la glicosiltransferasa (btrM, neo8); un supuesto gen de la aminotransferasa (similar a la glutamato-1-semialdehído 2,1-aminomutasa) (btrB, neo18); un supuesto gen de la alcohol deshidrogenasa (btrE, neo5); y otro supuesto gen de la deshidrogenasa (similar a la cloro deshidrogenasa y flavoproteínas relacionadas) (btrQ, neo11). [20] Queda por esclarecer una desacetilasa que actúe para eliminar el grupo acetilo en las fracciones de N-acetilglucosamina de los intermediarios aminoglucósidos (Neo16) (secuencia similar a BtrD). [21]
A continuación se produce la unión de la D -ribosa a través de la ribosilación de la neamina, utilizando 5-fosforibosil-1-difosfato (PRPP) como donante de ribosilo (BtrL, BtrP); [22] gen de la glicosiltransferasa (homólogos potenciales RibF, LivF, Parf) (Neo15). [23]
Lo más probable es que la neosamina B ( L -neosamina B) se biosintetice de la misma manera que la neosamina C ( D -niosamina) en la biosíntesis de neamina, pero con un paso de epimerización adicional necesario para explicar la presencia de la neosamina B epimérica en la neomicina B. [24]
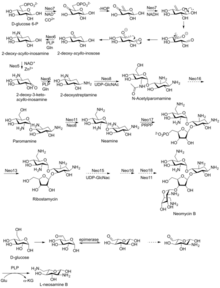
La neomicina B y C son moléculas de 23 carbonos con una estructura de cuatro anillos. Tres de los anillos tienen seis miembros y uno tiene cinco. [25] La neomicina B y la neomicina C son estereoisómeros entre sí y difieren solo en un estereocentro, uno que da la conformación R y el otro que da la conformación S. [25] La neomicina C puede sufrir síntesis enzimática a partir de la ribostamicina. [26]
La neomicina de grado estándar se compone de varios compuestos relacionados, entre ellos la neomicina A (neamina), la neomicina B (framicetina), la neomicina C y algunos compuestos menores que se encuentran en cantidades mucho menores. La neomicina B es el componente más activo de la neomicina, seguida de la neomicina C y la neomicina A. La neomicina A es un producto de degradación inactivo de los isómeros C y B. [27] Las cantidades de estos componentes en la neomicina varían de un lote a otro según el fabricante y el proceso de fabricación. [28]
Los aminoglucósidos como la neomicina son conocidos por su capacidad de unirse al ARN dúplex con alta afinidad. [29] La constante de asociación de la neomicina con el ARN del sitio A está en el rango de 10 9 M −1 . [30] Sin embargo, más de 50 años después de su descubrimiento, sus propiedades de unión al ADN aún eran desconocidas. Se ha demostrado que la neomicina induce la estabilización térmica del ADN tríplex, mientras que tiene poco o casi ningún efecto en la estabilización del dúplex de ADN-B. [31] También se ha demostrado que la neomicina se une a estructuras que adoptan una estructura en forma de A, siendo el ADN tríplex una de ellas. La neomicina también incluye la formación de tríplex híbridos ADN:ARN. [32]