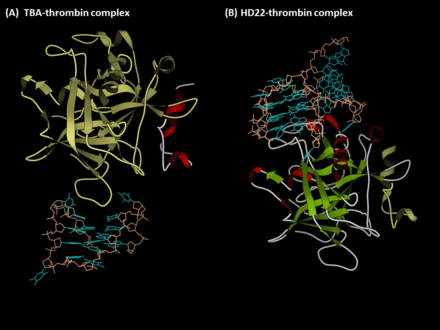
Los aptámeros antitrombina son oligonucleótidos que contienen G-quadruplex , que reconocen los exositios de la trombina humana . El primer aptámero antitrombina, TBA, fue generado a través de la tecnología SELEX ( Systematic Evolution of Ligands by Exponential Enrichment ) en 1992 por LC Bock, JJ Toole y colegas. [1] Un segundo aptámero de unión a la trombina, HD22, reconoce el exositio II de la trombina y fue descubierto en 1997 por NeXstar (ahora Gilead Sciences ). [2] Estos dos aptámeros tienen alta afinidad y buena especificidad y han sido ampliamente estudiados y utilizados para el desarrollo de terapias y diagnósticos basados en aptámeros.

El aptámero TBA (también conocido como G15D, HTQ, HD1, ARC183, GS522, BC-007 o Rovunaptabin ) es un ADN monocatenario de 15 meros con la secuencia 5 ' -GGTTGGTGTGGTTGG-3 ' . [1] Interactúa con el exositio I de la alfa-trombina humana, que es el sitio de unión del fibrinógeno , por lo que este aptámero actúa como un agente anticoagulante inhibiendo la activación del fibrinógeno así como la agregación plaquetaria. Además, el TBA muestra buena afinidad y especificidad frente a la trombina. La constante de disociación de la TBA-trombina se ha descrito en el rango nanomolar, y el TBA no interactúa con otras proteínas plasmáticas o análogos de la trombina (p. ej., gamma-trombina). [3] Como resultado, el TBA se ha utilizado como un anticoagulante de corto plazo diseñado para su aplicación en la cirugía de bypass de la arteria coronaria, y su forma optimizada (NU172) se encuentra ahora en la fase II de ensayo clínico por ARCA Biopharma (NCT00808964). [4] Además, debido a su alta afinidad y especificidad, se acoplaron una variedad de sensores con el TBA y se desarrollaron para el diagnóstico de trombosis.
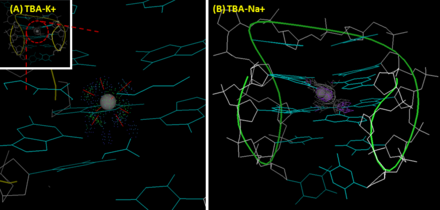
La estructura terciaria de TBA es un G-quadruplex antiparalelo. Esta estructura similar a una silla se pliega a través del apilamiento de dos tétradas de guanina (G) , y cuatro guaninas interactúan entre sí a través de enlaces de hidrógeno no similares a Watson-Crick (más probablemente enlaces de hidrógeno similares a Hoogsteen). En la estructura de TBA, G1, G6, G10 y G15 forman la capa superior de la tétrada G; G2, G5, G11 y G14 forman la segunda capa. Las primeras imágenes cristalográficas con una resolución de 2,9 Å (1HUT) se informaron en 1993. Mostraban que el bucle T7-G8-T9 y los bucles TT (T3-T4 y T12-T13) conectaban los surcos estrechos y anchos, respectivamente. [5] Sin embargo, desde que se proporcionaron las imágenes cristalográficas de rayos X y RMN mejoradas (1HAO) [6] y (4DIH; 4DII) [7] , se ha considerado otra topología con el bucle TGT en el lado ancho y los bucles TT en los sitios estrechos como una estructura correcta de TBA.
Además de la selectividad proteica, el TBA también muestra preferencia iónica. Un ion potasio ayuda al TBA a plegarse en una estructura G-quadruplex, lo que da como resultado una banda positiva significativa a 295 nm y una banda negativa a 270 nm en su espectro de dicroísmo circular (CD). Además, el ion potasio mejora la estabilidad térmica del TBA. [8] La temperatura de fusión del G-quadruplex del TBA (midiendo el cambio de intensidad del pico a 295 nm por CD) en presencia del ion sodio y el potasio son 24 °C y 53 °C, respectivamente. [7] En comparación con el sodio, el ion potasio se adapta perfectamente a la cavidad entre dos planos G-tetrad y está unido coordinadamente a cuatro átomos de O6 en cada plano. Esto mejora la estabilidad estructural del TBA. En contraste, debido a su pequeño tamaño, el ion sodio solo puede interactuar con cuatro átomos de oxígeno en lugar de ocho de dos planos G-tetrad y, en consecuencia, tiene dos posiciones alternativas en la cavidad. La trombina muestra una influencia similar a la del ion potasio. En condiciones de deficiencia de iones, la trombina ayuda a que el TBA se convierta en una estructura G-quadruplex estable a partir de una espiral aleatoria, lo que da como resultado un cambio conformacional. [8] Algunos grupos utilizan esta propiedad para desarrollar sensores de trombina basados en aptámeros. Para este propósito, el TBA generalmente se monta con una secuencia adicional con un par FRET ( transferencia de energía de resonancia de Förster ) para formar una estructura dúplex transitoria. Una vez que la parte del TBA interactúa con la trombina, el cambio conformacional cambiaría la distancia entre el par FRET y daría lugar a una salida fluorescente. Este enfoque proporciona una sensibilidad nanomolar y es capaz de detectar la trombina en el suero enriquecido. [9]
En 1996 se informó de un TBA modificado con inversión de polaridad de cadena, conocido como mTBA. Se diseñó una inversión 5'-5' entre T3 y T4 en la secuencia mTBA ( 3'-GGT-5'-5'TGGTGTGGTTGG-3' ). Esto mejora la estabilidad térmica de la estructura G-quadruplex y aumenta la temperatura de fusión en 4 °C. A pesar de esto, la actividad anticoagulante se ve afectada y reducida por el diseño de inversión. [10]
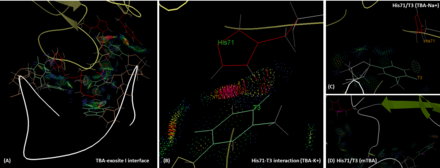
El TBA se une al exositio I de la trombina principalmente a través de sus dos bucles TT (T3, T4 y T12, T13) mediante interacciones polares e hidrofóbicas. Los residuos His71, Arg75, Tyr76, Arg77, Asn78, Ile79, Tyr117 en el epítopo del exositio I están involucrados en la interacción con el TBA. [7] El exositio 1, al ser un motivo cargado positivamente, participa en estas interacciones con la estructura principal cargada negativamente de HD1. [11] Es importante destacar que el T3 interactúa con His71, que desempeña un papel crítico para el reconocimiento del fibrinógeno, [12] tanto a través de enlaces de hidrógeno como de interacción hidrofóbica. Sin embargo, en presencia del ion sodio, el enlace de hidrógeno entre T3 e His71 se pierde, y la distancia intermolecular es más larga que en el caso del potasio. Esto reduce la afinidad y la funcionalidad del TBA. Se puede encontrar una situación similar en el caso del mTBA. No existen interacciones entre mTBA e His71, lo que resulta en la reducción de la actividad anticoagulante. [13] Los resultados de los cálculos in silico con el método de área de superficie de Poisson-Boltzmann de mecánica molecular (MM-PBSA), sugieren que la energía de unión calculada (ΔG) de TBA al exositio I de la trombina es ligeramente más fuerte en presencia de K+ (-66,73 kcal.mol-1) que en el caso de Na+ (-60,29 kcal.mol-1), sin embargo es probable que ambos estados coexistan. [14]
Se ha demostrado que el TBA puede inhibir la agregación plaquetaria inducida por trombina y la actividad de la trombina unida al coágulo. La CI50 del TBA para la inhibición de la agregación plaquetaria (0,5 U/mL de trombina) es de alrededor de 70 a 80 nmol/L, que es mucho menor que la de la hirudina (~1,7 umol/L). Además, en comparación con la heparina, el TBA es más eficiente en la inhibición de la trombina unida al coágulo. [15] Además, el TBA reconoce e inhibe la protrombina con una afinidad similar contra la alfa-trombina. Como resultado, el TBA prolonga el tiempo de protrombina cuando interactúa con la protrombina. [16] El TBA entró en la fase I de ensayos clínicos para cirugía de bypass de arteria coronaria por Archemix y Nuvelo (ahora ARCA Biopharma) alrededor de 2005. Aunque mostró una respuesta de inicio rápido con la actividad anticoagulante deseada, la actividad requiere una dosis significativamente alta de TBA. [17] Por lo tanto, las empresas rediseñaron la secuencia de TBA y desarrollaron un aptámero de ADN de 26 meros de segunda generación conocido como NU172, que ahora se encuentra en la fase II de ensayos clínicos. [4]


El aptámero HD22 (también conocido como HTDQ) es un aptámero optimizado con 29 ( 5 ' -AGTCCGTGGTAGGGCAGGTTGGGGTGACT-3 ' ) o 27 (falta el primero y el último nucleótido de la forma 29-mer) nucleótidos. [2] [18] Este aptámero reconoce el exositio II de la trombina, que está involucrado en la activación del factor V y el factor VIII y media la unión de la heparina . Por lo tanto, HD22 inhibe las activaciones de los factores V/VIII en lugar de la del fibrinógeno. A pesar de que este aptámero solo muestra un efecto moderado en la regulación del fibrinógeno, la afinidad de este aptámero es ligeramente superior a la del TBA (KD~0,5 nM), y hoy en día este aptámero se utiliza ampliamente para el desarrollo de sensores de aptámeros.
A diferencia de TBA, HD22 tiene una estructura mixta dúplex/G-quadruplex. La imagen cristalográfica de rayos X de HD22 (forma 27mer) con una resolución de 2,4 Å fue reportada recientemente (4I7Y). Los nucleótidos 1-3 y 25-27 con un C4-G23 adicional forman un motivo dúplex, y la secuencia que va de G5 a G20 se pliega en una estructura G-quadruplex con cuatro bucles de conexión: T9-A10, T18-T19, G13-C14-A15 y un bucle de un nucleótido (T6). En el núcleo del motivo G-quadruplex, se forman dos planos de tétrada G: G5-G7-G12-G16 y G8-G11-G17-G20. El plano superior (G5-G7-G12-G16) no es una típica tétrada G con la topología de cadena de alternancia anti - syn - anti - syn . En cambio, tres guaninas (G5, G7 y G16) adoptan la conformación syn , y solo una guanina (G12) adopta la conformación anti . Además, el bucle de un nucleótido insertado entre G5 y G7. Esto hace que la tétrada G no se forme a través de un patrón cíclico típico. Este plan inusual de tétrada G está formado por cuatro enlaces de hidrógeno: uno en N2:N7 (G5-G16), dos en O6:N7 (G12-G7; G16-G12) y uno en O6:N2 (G7-G5). Se podrían encontrar otras interacciones en el motivo G-cuadrúplex: dos pares de bases Watson-Crick (T6-A15 y A10-T19) y una horquilla G (G5-G21). Es importante destacar que, debido a la interacción entre G5 y G21, hay un giro de 90 grados entre los motivos G-cudruplex y dúplex. [19]
Los nucleótidos G23, T24, G25, A26, C27 en el dúplex y T9, T18, T19, G20 en el G-quadruplex contribuyen a la interacción con el exositio II de la trombina. Del lado de la proteína, los residuos Tyr89, His91, Pro92, Arg93, Tyr94, Asn95, Trp96, Arg97, Arg126, Leu130, Arg165, Lys169, His230, Arg233, Trp237, Val241 y Phe245 en la trombina están involucrados en la interacción. Dado que el exositio II es un motivo cargado positivamente, crea muchos pares de iones con la cadena principal HD22, especialmente en la región del dúplex. Las interacciones hidrofóbicas se observan principalmente en la región del G-quadruplex (T9, T18 y T10), y esto estabiliza la formación del complejo. Además, la interacción con la trombina mejora la estabilidad térmica de la estructura de HD22 y da como resultado el aumento de la temperatura de fusión (de 36 a 48 °C). [19] La energía de enlace calculada de HD22 al exositio II de la trombina es -88,37 -kcal.mol-1. [14]
De manera similar al anticuerpo, los aptámeros TBA y HD22 muestran un efecto de avidez contra la trombina después de la dimerización. Cuando TBA y HD22 se conjugan con un enlazador óptimo [20] [21] o se co-imprimen en la superficie del sensor con una densidad óptima, [22] la afinidad contra la trombina podría mejorarse significativamente de 100 a 10,000 veces. Además, la dimerización también mejora la actividad anticoagulante. El constructo TBA-HD22 (ligado con poliA de 16 meros) muestra una mejora significativa tanto en el ensayo del tiempo de tromboplastina parcial activada , el tiempo de coagulación y la agregación plaquetaria inducida por trombina. El constructo TBA-HD22 muestra una eficacia comparable en comparación con la bivalirudina , pero mucho más potente que el argatrobán . Además, la avidez de TBA-HD22 se puede examinar mediante el tiempo de coagulación de la ecarina . La ecarina activa la protrombina y, en consecuencia, produce meizotrombina. El exositio II no es accesible en la meizotrombina, por lo que la parte HD22 no puede interactuar con la meizotrombina directamente. Como resultado, la construcción TBA-HD22 no puede mejorar el tiempo de coagulación de la ecarina, lo que demuestra además que la mejora de la funcionalidad del aptámero se debe a la avidez de TBA-HD22. [23]