
La terapia sonodinámica (TSD) es un tratamiento no invasivo, que se utiliza a menudo para la irradiación de tumores, que utiliza un sonosensibilizador y la penetración profunda de ultrasonidos para tratar lesiones de distintas profundidades al reducir el número de células diana y prevenir el crecimiento futuro del tumor. [1] [2] Muchas de las estrategias de tratamiento del cáncer existentes causan toxicidad sistémica o no pueden penetrar el tejido lo suficientemente profundo como para alcanzar todo el tumor; sin embargo, las terapias emergentes estimuladas por ultrasonidos podrían ofrecer una alternativa a estos tratamientos con su mayor eficiencia, mayor profundidad de penetración y menores efectos secundarios. La terapia sonodinámica podría usarse para tratar cánceres y otras enfermedades, como la aterosclerosis, y disminuir el riesgo asociado con otras estrategias de tratamiento, ya que induce efectos citotóxicos solo cuando se estimula externamente con ultrasonidos y solo en la región cancerosa, a diferencia de la administración sistémica de medicamentos de quimioterapia. [3] [4] [5]
.jpg/440px-Photodynamic_therapy_(2).jpg)
Las especies reactivas de oxígeno (ROS) son un componente esencial de la SDT, ya que proporcionan la citotoxicidad de la terapia sonodinámica; se producen cuando el ultrasonido se combina con un fármaco sensibilizante y oxígeno molecular. [1] Sin ultrasonido, el fármaco no es tóxico. Sin embargo, una vez que el fármaco se expone al ultrasonido y al oxígeno molecular, se vuelve tóxico. [1] La terapia fotodinámica , de la que se derivó la terapia sonodinámica, utiliza un mecanismo similar. En lugar de ultrasonido, se utiliza luz para activar el fármaco. [1] La SDT permite que el ultrasonido llegue más profundamente al tejido (hasta unos 30 centímetros) en comparación con la terapia fotodinámica (PDT), ya que puede estar muy enfocada. [1] Esta mayor profundidad de penetración significa en última instancia que la SDT se puede utilizar para tratar tumores más profundos y menos accesibles y es más rentable que la PDT. [6] [1] La terapia fotodinámica se puede utilizar en combinación con la terapia sonodinámica y se amplía en la sección Aplicaciones de este artículo. La terapia sonodinámica se puede utilizar sinérgicamente con otros métodos terapéuticos, como microburbujas cargadas con fármacos, nanopartículas, exosomas, liposomas y genes, para mejorar la eficacia. Actualmente, la terapia sonodinámica no tiene ningún producto clínico y actúa como adyuvante para los métodos terapéuticos antes mencionados, pero se ha explorado su uso en el tratamiento de la aterosclerosis y el cáncer para reducir el tamaño de los tumores en los sarcomas de mama, páncreas, hígado y columna vertebral. [7] [3] [8] [9] [10] [11] [12] [13] [14] [15] [16]

El mecanismo de acción de la terapia sonodinámica es el uso de ultrasonidos de baja intensidad mediante el uso de ondas mecánicas enfocadas para crear un efecto citotóxico. Sin embargo, la SDT en sí no es térmica, no tóxica y puede penetrar profundamente en el tejido de forma no invasiva en comparación con otros métodos de administración como la terapia fotodinámica. La SDT a menudo se realiza junto con el uso de un sonosensibilizador como porfirina , ftalocianinas , xantenos y fármacos antitumorales. [17] Las ondas de ultrasonido también se clasifican como ondas acústicas, y el efecto que tienen sobre el tejido de aplicación puede describirse mediante un proceso llamado cavitación. La cavitación ocurre como una interacción específica entre el ultrasonido y el entorno acuoso y hace que las burbujas de gas se rompan al exponerse a parámetros ultrasónicos particulares, promoviendo así la penetración del terapéutico en los tejidos biológicos al generar cavidades cerca del borde de la membrana. [18] [1] La cavitación se puede dividir en cavitación estable e inercial. En la cavitación estable, la oscilación de las burbujas de gas hace que los medios ambientales se entremezclen. [1] En la cavitación inercial, las burbujas de gas aumentan de volumen y casi alcanzan su volumen de resonancia, hinchándose antes de colapsar agresivamente. [ 1] La implosión de vesículas da como resultado un cambio drástico de temperatura y presión, lo que aumenta la permeabilidad de la membrana celular a varios fármacos. [1] [19] Las microburbujas son creadas por las ondas acústicas del ultrasonido que se expanden y colapsan, liberando energía, llevando al sonosensibilizador a un estado excitado y generando un ROS. La cavitación de esta burbuja de gas puede formar el ROS con diferentes metodologías, como la sonoluminiscencia y la pirólisis . [1] La apoptosis resulta de la formación de ROS y las fuerzas mecánicas de SDT a través de la ruptura de la membrana en un proceso llamado peroxidación lipídica. La necrosis también es un resultado potencial de SDT. [ cita requerida ]
La influencia de la sonoluminiscencia en la SDT y las ROS no se ha elaborado completamente en la literatura. [1] Actualmente, se entiende que la sonoluminiscencia permite la emisión de luz tras el colapso de las burbujas, lo que puede activar los sensibilizadores. Un estudio de Hachimine et al. destaca el uso de la SDT como método para activar un sonosensibilizador de baja fotosensibilidad, DCPH-P-Na(I), para el cáncer que se encuentra demasiado profundo en el tejido para combatirlo utilizando PDT sin irritación de la piel. [1] [20] La pirólisis eleva la temperatura circundante, mejora el proceso de cavitación, descompone el sensibilizador, generando radicales libres, y los radicales libres interactúan dentro de su entorno para generar ROS. [1] Para ambos métodos, se ha destacado la importancia del oxígeno singlete en comparación con el radical hidroxilo para inducir la citotoxicidad. [1] [20] [21] Mientras que otros estudios [1] [22] [23] han descubierto que el oxígeno singlete no tiene un efecto sustancial. En general, ambas metodologías carecen de una amplitud significativa en la literatura para explicar completamente su papel en la formación de ROS. Sin embargo, la literatura ha demostrado éxito en su análisis y aplicación. [1] [4] [24]

Existen dos mecanismos principales de generación de ROS en la terapia sonodinámica: sonoluminiscencia y pirólisis. [1] La sonoluminiscencia ocurre cuando el ultrasonido produce luz después de irradiar una solución acuosa [1] [25] El mecanismo exacto con el que se produce la luz sigue sin estar claro. Sin embargo, se sugiere que la cavitación inercial es un elemento clave para este proceso. [1] [26] Otros estudios también indican el papel potencial de la cavitación estable [1] [27]
Se cree que la pirólisis ocurre cuando la cavitación inercial induce un aumento extremo de la temperatura, degrada los sonosensibilizadores y produce radicales libres que pueden reaccionar y, en última instancia, producir ROS necesarios para la SDT. [1] [28] El aumento localizado de la temperatura ayuda a la cavitación inercial y la descomposición del sonosensibilizador para crear ROS. La pirólisis dentro de las burbujas de cavitación producirá H+ y OH- a través de enlaces débiles dentro de la molécula de soluto. [1] [19]

Además de los métodos químicos, las propiedades mecánicas de la onda acústica generada por el ultrasonido pueden ayudar a iniciar los efectos citotóxicos. Esto ocurre a través de la ruptura de la membrana con un sonosensibilizador hidrofóbico. La ruptura mecánica de la membrana provoca un proceso llamado peroxidación lipídica y los ajustes a la membrana celular pueden cambiar la permeabilidad de los fármacos en las células. [1] [29] Se utilizan metodologías sonoquímicas y sonomecánicas para generar ROS y liberar la carga de las vesículas para aplicaciones como la focalización tumoral. [ cita requerida ]
En la literatura anterior se ha demostrado que los ultrasonidos de baja intensidad inducen efectos apoptóticos en las células circundantes. Se ha descubierto que no son las ROS iniciales las que provocan la apoptosis dentro de las células, sino los radicales libres dentro de las mitocondrias. En un estudio de Honda et al., se determinó que la vía mitocondria-caspasa es responsable de la apoptosis a través del aumento del calcio intracelular. [1] [30] Además de la apoptosis inducida por ROS, la cavitación es otro factor involucrado en la apoptosis de las células circundantes. Ambos tipos de cavitación pueden inducir la apoptosis a través del daño a la membrana. Se pueden manipular condiciones como la frecuencia, el ciclo de trabajo, el pulso y la intensidad para optimizar las condiciones de muerte celular, como la necrosis, la lisis o la apoptosis. [31] [24] [32]
Este método de muerte celular puede ocurrir cuando los orgánulos celulares quedan atrapados en los autofagosomas que se combinan con los lisosomas. La continuación de este proceso conducirá a la muerte celular y los inhibidores o promotores de la autofagia pueden controlarse para estimular o desalentar la muerte celular y la absorción de quimioterapéuticos. [1]
Los sonosensibilizadores, o terapias sonosensibilizadoras, son el elemento principal de la terapia de ultrasonidos y pueden adaptarse para tratar diversos tipos de cáncer y generar diferentes efectos. [2] Estas terapias, que a menudo implican el uso de porfirina o xanteno, iniciarán un efecto tóxico a través de las ROS tras la exposición al ultrasonido. [ cita requerida ]

Los sensibilizadores a base de porfirina, utilizados inicialmente como fotosensibilizadores en la terapia fotodinámica, son moléculas bastante hidrófobas derivadas de la hematoporfirina. [1] Los sensibilizadores a base de porfirina producen átomos de oxígeno individuales o radicales hidroxilo tras la exposición a ultrasonidos o luz, lo que proporciona los efectos citotóxicos deseados con las terapias sonodinámicas y fotodinámicas. [1] Sin embargo, el resultado de los sensibilizadores a base de porfirina no es tan local como se desea para la terapia sonodinámica, ya que también se encuentran en tejido no objetivo entre el tumor y el emisor de ultrasonidos. [1]


Por otro lado, los sensibilizadores a base de xanteno han demostrado una citotoxicidad exitosa in vitro al producir especies reactivas de oxígeno después de ser activados por ultrasonido. [1] Se necesita más investigación para mejorar su potencial desempeño in vivo, ya que es procesado rápidamente por el hígado y eliminado del cuerpo. [1] El rosa de Bengala es un sonosensibilizador a base de xanteno de uso común. [1]
Otros sensibilizadores que han sido investigados por su potencial en la terapia sonodinámica (y que también se han utilizado previamente en PDT) incluyen naranja de acridina , azul de metileno , curcumina y verde de indocianina . [1] Un estudio de Suzuki et al. utilizó naranja de acridina, un tinte catiónico fluorescente que puede insertarse en los ácidos nucleicos, para tratar células del sarcoma 180 con ultrasonido y demostró que las especies reactivas de oxígeno son un elemento crítico de la SDT considerando que su ausencia disminuyó la eficacia de la SDT. [33] Similar al estudio anterior, un estudio reciente de Komori et al. utilizó ultrasonido acoplado con azul de metileno (un tinte de fenotiazina comúnmente utilizado en PDT que exhibe baja toxicidad) para irradiar células del sarcoma 180 y encontró que el azul de metileno era un sonosensibilizador eficaz para disminuir la viabilidad celular. [34] Curiosamente, la curcumina es una especia que también puede actuar como sensibilizador para PDT y SDT. [1] En un estudio de Waksman et al., la curcumina pudo afectar a los macrófagos, que son importantes para el desarrollo de las placas que se encuentran en los pacientes con aterosclerosis, reduciendo así la cantidad de placa en un modelo animal. [35] Estos hallazgos, junto con otras investigaciones, indican que los sensibilizadores de la curcumina podrían usarse en los tratamientos contra el cáncer con terapia de reemplazo de citocinas. El verde de indocianina es un tinte que absorbe longitudes de onda del infrarrojo cercano y es otro sensibilizador que ha demostrado reducir la viabilidad celular cuando se combina con ultrasonido y/o luz. [36] Un estudio in vivo demostró que el tratamiento de un modelo de tumor de ratón con verde de indocianina junto con ultrasonido y luz resultó en una reducción del 98% en el volumen del tumor a los 27 días después del tratamiento. [36]
Como se mencionó anteriormente, los sonosensibilizadores a menudo se utilizan junto con diferentes portadores de fármacos, como microburbujas, nanoburbujas, liposomas y exosomas para mejorar la concentración y la penetración del agente terapéutico. [18]

Los liposomas son un vehículo común en la administración de fármacos y específicamente para el tratamiento del cáncer. Los liposomas contienen una bicapa de fosfolípidos. Es frecuente debido a su capacidad de penetrar la vasculatura permeable y el drenaje linfático deficiente dentro de los tumores para una mejor retención de la permeabilidad. [37] Estos portadores de fármacos pueden encapsular moléculas hidrófobas y lipófilas dentro de su bicapa lipídica y pueden fabricarse de forma natural o sintética. [38] [39] Además, los liposomas pueden atrapar moléculas hidrófilas en su núcleo hidrófilo. [38] En comparación con la quimioterapia común para el tratamiento del cáncer, los fármacos cargados en liposomas permiten una menor toxicidad sistémica y un posible aumento de la eficacia de la administración dirigida. [18] El éxito de los liposomas como sistemas de administración de fármacos se ha demostrado tanto in vivo como in vitro. [38] Un estudio de Liu et al. mostró que los liposomas se pueden utilizar junto con la SDT para desencadenar la liberación de fármacos a través de la oxidación de los componentes lipídicos. [40] Otro estudio de Ninomiya et al. Utilizaron gotas de nanoemulsión expuestas a ondas ultrasónicas para la formación de burbujas de gas más grandes para romper la membrana de los liposomas y liberar el fármaco. Muchas propiedades y elementos de los liposomas se pueden alterar para su propósito específico y para aumentar la eficacia, en particular su capacidad para viajar en la sangre e interactuar con las células y los tejidos del cuerpo. [38] Estos elementos incluyen su diámetro, carga, disposición, así como la composición de sus membranas. [38] Dai et al. propusieron la incorporación de sonosensibilizadores con liposomas para mejorar la especificidad del objetivo. [18] Dado que la SDT estimula los tejidos cancerosos para absorber y retener los sonosensibilizadores seguido de la activación con ultrasonido extracorpóreo, Dai et al. investigaron el efecto de los fármacos encapsulados en liposomas sobre la eficacia de la administración dirigida en la SDT. Descubrieron que, además de su conveniencia y practicidad, la SDT es una opción segura y eficaz para tratar el cáncer. [18]
Los exosomas son nanotransportadores que pueden proporcionar una administración dirigida de fármacos terapéuticos para mejorar los efectos citotóxicos locales y minimizar cualquier impacto sistémico. Se adquieren de las células y se utilizan para fines de transporte dentro de la célula como vesículas unidas a la membrana. Las ventajas de los exosomas para fines de administración de fármacos incluyen su capacidad de ser manipulados y diseñados, además de su baja toxicidad e inmunogenicidad. [41] [42] También han inspirado la investigación sobre métodos de tratamiento no basados en células para varios cánceres y enfermedades. [41] Otros aspectos deseables de los exosomas incluyen su biocompatibilidad y estabilidad generales. [42] Un estudio de Nguyen Cao et al. investigó el uso de exosomas para la administración de verde de indocianina (ICG), un sonosensibilizador para el tratamiento del cáncer de mama. [43] Se observó una generación significativamente mayor de especies reactivas de oxígeno en células de cáncer de mama tratadas con exosomas conjugados con ácido fólico. [43] Este es un ejemplo de un sonosensibilizador utilizado para tratar un cáncer específico mediante terapia sonodinámica. Otro ejemplo de terapia sonodinámica basada en exosomas fue ilustrado por Liu et al. En este estudio, los exosomas fueron decorados con sensibilizadores de porfirina y este sistema se utilizó con un dispositivo de ultrasonido externo para controlar y dirigir la administración de fármacos a través de SDT. [40] Liu et al. proporcionó un método no invasivo para tratar el cáncer a través de la activación extracorpórea de exosomas a través de ultrasonido. [40]

Debido a su capacidad de oscilar con la exposición a ultrasonidos de baja frecuencia, las microburbujas se han utilizado como agentes de contraste para visualizar los tejidos en los que han penetrado. [44] Sin embargo, cuando estas microesferas se exponen a ultrasonidos de mayor presión, pueden romperse, lo que podría ser beneficioso para la administración de fármacos. [44] A través de SDT, estas microburbujas podrían estallar selectivamente en el microambiente del tumor para disminuir los niveles sistémicos del fármaco encapsulado y aumentar la eficacia terapéutica. Al aplicar SDT, el aumento de la presión acústica conduce a la cavitación inercial o colapso de la microburbuja y liberación local de la carga en su interior. La cavitación inercial de las microburbujas cuando se exponen a SDT también se conoce como destrucción de microburbujas mediada por ultrasonidos (UMMD). [45] La cubierta de las microburbujas se puede decorar con diferentes componentes, incluidos polímeros, lípidos o proteínas, según su propósito previsto. [44] Las microburbujas también se han utilizado para la liberación localizada de carga adherida. Esta carga es típicamente quimioterapéutica, antibióticos o genes. [12] Diferentes fármacos pueden cargarse directamente en la microburbuja con métodos tales como conjugación y nanopartículas, carga de liposomas y genes. La combinación de genes y SDT se conoce como sonotransfección. [12] Ejemplos de modificaciones de la capa externa pueden verse en un estudio de McEwan et al. que encontró que las microburbujas lipídicas mostraron una estabilidad reducida cuando se añadieron sonosensibilizadores a sus capas. [44] Sin embargo, unir el polímero ácido poliláctico-co-glicólico (PLGA) a la capa resultó en una mayor estabilidad en comparación con las microburbujas lipídicas sin perder otras propiedades deseables tales como administración dirigida y citotoxicidad selectiva. [44] En otro estudio, McEwan et al. investigaron la capacidad de las microburbujas que transportan oxígeno para aumentar la producción de especies reactivas de oxígeno, que son un componente necesario de la SDT, en el entorno hipóxico de muchos tumores sólidos. [46] Estas microburbujas se estabilizaron con lípidos y se adhirió un sonosensibilizador de rosa de Bengala a la superficie para tratar el cáncer de páncreas. [46] Su trabajo demostró que el acoplamiento de microburbujas cargadas de oxígeno que son sensibles a los ultrasonidos con fármacos sonosensibilizadores podría permitir una mayor activación del fármaco en el objetivo deseado incluso si hay hipoxia. Algunos ejemplos de terapias que se han cargado en microburbujas son gemcitabina, nanopartículas de paclitaxel, ADN plasmídico y liposomas cargados con diclorhidrato de 2,2′-azobis[2-(2-imidazolin-2-il)propano]. [47] [45] [48] [49]Debido a la naturaleza de orientación de los ligandos conectados a la microburbuja, se permite la orientación controlada y específica del tejido deseado para el tratamiento. Otro estudio realizado por Nesbitt et al. ha demostrado una reducción tumoral mejorada cuando se cargó gemcitabina en la microburbuja y se aplicó a un modelo de xenoinjerto de cáncer de páncreas humano con SDT. [48]
De manera similar a las microburbujas, las nanoburbujas han demostrado eficacia en la SDT. [50] Sin embargo, debido a su menor tamaño, las nanoburbujas pueden alcanzar objetivos que las microburbujas no pueden. Las nanoburbujas pueden alcanzar tejidos más profundos y viajar más allá de la vasculatura. Investigaciones anteriores han demostrado que las nanoburbujas son más capaces de alcanzar el tumor ya que pueden permear las células endoteliales y migrar lejos de la vasculatura. [51] [50] Un estudio de Nittayacharn et al. desarrolló nanoburbujas cargadas con doxorrubicina y las emparejó con sensibilizadores de porfirina para usar en SDT para el tratamiento de células de cáncer de mama y ovario in vitro. [50] Encontraron un aumento de casi el 70% en la citotoxicidad al usar SDT en comparación con solo nanoburbujas de perfluoropropano llenas de iridio (III). [50] Además, en comparación con las nanoburbujas vacías y/o el iridio(III) libre, observaron la mayor generación de especies reactivas de oxígeno en las nanoburbujas de iridio(III) expuestas a ultrasonidos. [50] Estos resultados demuestran que las nanoburbujas cargadas con un sonosensibilizador y expuestas a ultrasonidos podrían ser un posible tratamiento eficaz para el cáncer utilizando SDT. Al igual que con las microburbujas, las nanoburbujas también han demostrado ser prometedoras como vesículas transportadoras de oxígeno para mejorar la eficacia de SDT. Para mitigar la hipoxia del tejido diana, Owen et al. utilizaron un modelo de roedor de cáncer de páncreas para administrar nanoburbujas estabilizadas con fosfolípidos llenas de oxígeno. [52] Los ratones se dividieron en grupos, uno que recibió nanoburbujas llenas de oxígeno antes de la inyección de un sonosensibilizador y otro que no. [52] Se observó una diferencia estadísticamente significativa entre los niveles de oxígeno en los tumores de los dos grupos, lo que indica que las nanoburbujas podrían ser una adición eficaz a SDT para tratar cánceres en un entorno hipóxico. [52]
La terapia sonodinámica se puede combinar con otras técnicas terapéuticas para mejorar la eficacia del tratamiento para varios tipos de cánceres y enfermedades. La terapia sonodinámica se puede combinar con terapia fotodinámica, quimioterapia, radiación, resonancia magnética e inmunoterapia. La terapia fotodinámica se ha utilizado a menudo en combinación con la terapia sonodinámica, ya que los sonosensibilizadores también son fotosensibles. [1] Durante el desarrollo inicial de la terapia sonodinámica, Umemura et al., determinaron que las hematoporfirinas podían iniciar la muerte celular de forma similar a la terapia fotodinámica. [21] Esto se debe a que la terapia sonodinámica puede iniciar la sonoluminiscencia. Sin embargo, la ventaja de la terapia sonodinámica sobre la terapia fotodinámica es que puede penetrar profundamente y con precisión en el tejido diana. En un estudio de Lui et al., se demostró que el uso de una combinación de estos dos métodos de administración da como resultado una mayor citotoxicidad con sinoporfirina en un modelo de xenoinjerto metastásico. [53] En otro ejemplo de combinación de la terapia sonodinámica con la terapia fotodinámica, Borah et al. Se investigó la ventaja del 2-(1-hexiloxietil)-2-devinil pirofeoforbida-a (HHPH), un fármaco de terapia fotodinámica, como sonosensibilizador y fotosensibilizador para el tratamiento del glioblastoma. [54] La combinación de estas terapias mostró un aumento de la muerte celular/respuesta tumoral, posiblemente causada por efectos sinérgicos. [54]
El objetivo de un estudio de Browning et al. fue investigar la posible mejora de la eficacia de la quimiorradiación mediante su combinación con terapia sonodinámica en pacientes con cáncer de páncreas. En un modelo, la supervivencia aumentó con la combinación en comparación con la quimiorradiación sola. Las diferencias en los resultados de los dos modelos diferentes podrían atribuirse a variaciones en la organización del tumor. [6] Los tumores que mostraron la mayor reducción de tamaño estaban menos vascularizados, lo que quizás los hacía más vulnerables a la terapia de reemplazo de tejido (SDT). [6] Otro estudio, de Huang et al., utilizó elementos de nanosistemas basados en organosílice mesoporosa para fabricar un sonosensibilizador para su uso con la terapia de reemplazo de tejido guiada por resonancia magnética. [55] Los sonosensibilizadores indujeron un aumento de la muerte celular y la inhibición del crecimiento tumoral, lo que indica una alta eficiencia de la SDT. [55] Esto demuestra cómo la SDT puede ayudar tanto con la eliminación como con la inhibición del crecimiento tumoral. [ cita requerida ]
La terapia inmunosónica de reemplazo (SDT) también se ha combinado con inmunoterapia. Un estudio de Lin et al. tuvo como objetivo utilizar la terapia inmunosónica de reemplazo en cascada para mejorar el tratamiento de tumores utilizando anticuerpos. [56] Los nanosonosensibilizadores dieron como resultado una alta eficiencia de carga de fármacos y una respuesta inmunitaria adaptativa específica del tumor. Esto sirve como ejemplo de cómo la SDT se puede combinar con la inmunoterapia de bloqueo de puntos de control para mejorar la eficiencia en los tratamientos contra el cáncer. Otro estudio de Yue et al. se esforzó por combinar la inmunoterapia de bloqueo de puntos de control con la terapia sonodinámica no invasiva aumentada con nanosonosensibilizadores. [57] Además de inhibir la metástasis pulmonar, esta combinación promovió una respuesta antitumoral que impidió el crecimiento del tumor. Esto proporciona una prueba de concepto para combinar la SDT con otra terapia para mejorar los efectos del tratamiento a corto y largo plazo. [ cita requerida ]
Se ha investigado el tratamiento de muchos tipos diferentes de cáncer utilizando terapia sonodinámica tanto in vitro como in vivo, incluidos los cánceres de glioblastoma, páncreas, mama, ovario, pulmón, próstata, hígado, estómago y colon. [54] [6] [20] [50] [52] Un estudio de Gao et al. mostró que la SDT es capaz de inhibir la angiogénesis a través de la producción de ROS. Esto dificultó la proliferación, migración e invasión de células endoteliales, el crecimiento tumoral, la vascularidad intratumoral y la expresión del factor de crecimiento endotelial vascular dentro de la célula tumoral en modelos de rata de xenoinjerto. [58] Hachimine et al. realizaron un gran estudio in vitro para probar la SDT en diecisiete líneas celulares cancerosas diferentes. [20] Los tipos de cáncer incluidos fueron cáncer de páncreas, mama, pulmón, próstata, hígado, estómago y colon. [20] El tratamiento más exitoso fue el del cáncer de pulmón con un 23,4% de viabilidad celular después de la terapia. [1] [20] Qu et al. se propuso desarrollar una plataforma nanosensibilizadora "todo en uno" activada por SDT que combina varios efectos diagnósticos y terapéuticos para tratar el glioblastoma. [59] Se indujo con éxito la apoptosis y se inhibió la mitofagia en las células de glioma. Este es un ejemplo de cómo se puede utilizar la SDT con una plataforma diferente para tratar el glioblastoma. Borah et al., como se mencionó anteriormente, también investigaron la capacidad de la SDT (y la PDT) para tratar el glioblastoma y descubrieron que la SDT (combinada con la PDT) podía aumentar la cantidad de células tumorales eliminadas. [54] McEwan et al. y Owen et al. demostraron el uso de micro/nanoburbujas para mejorar la concentración de oxígeno cerca de los tumores pancreáticos hipóxicos, aumentando así la eficacia de la SDT. [46] [52]

El 12% de las mujeres en los EE. UU. serán diagnosticadas con cáncer de mama . [60] La metástasis y la recurrencia son un gran desafío para los tumores sólidos profundos. [39] Actualmente, se está explorando la SDT como un método de tratamiento para el cáncer de mama, evitando al mismo tiempo los efectos secundarios asociados con los métodos terapéuticos actuales. [61] Se ha demostrado el éxito en la utilización de SDT en ensayos clínicos animales y humanos en la reducción del tamaño del tumor a través de la orientación mitocondrial para iniciar la apoptosis de las células tumorales y la autofagia y la regulación de la respuesta inmune. [62] [39] [63] [64] [24] [53] [60] [65] [61] Sin embargo, todavía existen complicaciones con la eficacia terapéutica adecuada cuando se usa sola.

El glioma maligno es un tumor cerebral extremadamente difícil de tratar que es una de las principales causas de muerte en todo el mundo y la mitad de las muertes relacionadas con el cáncer. [14] Las complicaciones asociadas con el tratamiento del glioma incluyen la barrera hematoencefálica (BHE). [14] Este mecanismo protector del cerebro también plantea desafíos para la administración de medicamentos a través de las uniones estrechas entre las células endoteliales, permitiendo que solo los medicamentos liposolubles pequeños (<400 Da) penetren. [14] Los métodos de administración actuales son la cirugía y la quimioterapia. La SDT se ha implementado como un método para abrir la BHE y ha demostrado ser exitosa en la apertura de las uniones estrechas para la administración. Ejemplos de sonosensibilizadores que han demostrado ser exitosos en el tratamiento del glioma son el hematoporfirina monometil éter (HMME), el porfímero sódico (Photofrin), el di-sulfo-di-ftalimidometil ftalcianinazinc (ZnPcS2P2), Photolon, el ácido 5-aminolevulínico (5-ALA) y el rosa de Bengala (RB). [14] Se ha demostrado que estos inducen efectos como la apertura de la BHE, la mejora de la permeabilidad vascular y la apoptosis de las células de glioma. [ cita requerida ]

El cáncer de próstata es la segunda causa de cáncer y la neoplasia maligna más común asociada con muertes en hombres en todo el mundo. [66] Los métodos actuales de tratamiento son la terapia de resección invasiva, la radioterapia y la prostatectomía que pueden causar complicaciones como incontinencia, impotencia y daño a los órganos y tejidos circundantes. [67] [17] Los estudios actuales han demostrado el éxito en el uso de SDT como un tratamiento independiente. [68] SDT utiliza la apoptosis relacionada con las mitocondrias para la reducción de la viabilidad celular. SDT para el tratamiento del cáncer de próstata también se ha utilizado junto con quimioterapéuticos como las microburbujas de docetaxel. [17] [67] [68] Esto ha demostrado mejorar los efectos de docetaxel a través de una reducción en la perfusión tumoral y una necrosis y apoptosis mejoradas. [68] El grupo SDT y docetaxel mostró una reducción en el crecimiento tumoral. [68] En general, el uso de SDT ha mostrado resultados prometedores en el tratamiento del cáncer de próstata. [ cita requerida ]
La terapia sonodinámica podría utilizarse para tratar más que sólo cánceres. La aterosclerosis , que es una enfermedad arterial crónica, es otro objetivo que se ha observado en la literatura. [3] [5] Esta enfermedad ocurre cuando las placas grasas se agregan en la superficie interna de la arteria y podría ser causada por disfunciones en el metabolismo de los lípidos. [3] Más específicamente, la aterosclerosis es causada por un aumento en la permeabilidad endotelial que hace que las partículas de lipoproteína de baja densidad se oxiden y sufran sedimentación. [3] Estas lipoproteínas causan un aumento de macrófagos y conducen a una acumulación intensificada de placa. Como resultado, la alta afluencia de macrófagos es el objetivo del tratamiento de la EA para frenar la acumulación de placa. [3] Junto con la relación entre la acumulación de placa y los macrófagos, la diferenciación de monocitos en macrófagos exacerba el proceso mencionado anteriormente además de causar inflamación. [3]
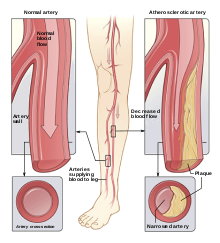
Un estudio de Wang et al. tuvo como objetivo comprender los mecanismos subyacentes con respecto al efecto potencial de la SDT no letal en las placas ateroscleróticas. Se determinó que la SDT no letal previene el desarrollo de la placa. [5] Un estudio realizado por Jiang et al., mostró éxito en la SDT a través de la reducción de factores inflamatorios de macrófagos como TNF-alfa, IL-12 e IL-1B. También demostraron que la SDT podría inhibir la inflamación de la placa en pacientes con enfermedad arterial periférica y continuar promoviendo resultados positivos durante más de seis meses. [4] Los sonosensibilizadores populares para el tratamiento de la EA son la protoporfirina IX (PpIX) y el ácido 5-aminolevulínico (5-ALA). [69] [3] La PpIX se usa a menudo en la PDT y se genera a través de 5-ALA, un componente no activado por ultrasonido, al aumentar la concentración de PpIX dentro de una célula. Un estudio de Cheng et al. Se determinó que la apoptosis de macrófagos THP-1 es inducida por un aumento en la concentración de PpiX, lo que conduce a la producción de grandes cantidades de ROS. [70] [13] [3] El uso de SDT para el tratamiento de la EA también ha demostrado tener éxito en la promoción de la repoblación de células musculares lisas vasculares (VMSC) mediante la inducción de una mayor expresión y autofagia para prevenir la evolución de las VMSC a macrófagos que sostienen la placa. Un estudio realizado por Dan et al. mostró el aumento de la fosforilación de la a-actina del músculo liso, 22a del músculo liso, proteína quinasa activada por mitógeno p38. [71] [3] Mientras que un estudio de Geng et al. mostró una autofagia mejorada de las VMSC. Cada uno de estos factores contribuyó a la diferenciación y el desarrollo mejorados de las VMSC. [3]
La experimentación in vitro proporciona una gran perspectiva y conocimiento para caracterizar el potencial del comportamiento del sonosensibilizador in vivo. Además, la SDT ha demostrado ser exitosa a través de su baja intensidad que permite una mayor permeabilidad de la membrana plasmática sin muerte celular. [1] Los sonosensibilizadores también se han utilizado in vitro en aplicaciones con diferentes líneas celulares y para comprender mejor el mecanismo de acción para la muerte celular. Actualmente se entiende que la PDT y la SDT tienen mecanismos similares para la generación de radicales libres para inducir la apoptosis y la necrosis. [1] Sin embargo, cada línea celular es única y puede causar la muerte celular con diferente eficacia. [20] [1] [72] Algunos ejemplos de trabajo in vitro incluyen estudios iniciales que fueron realizados por Yumita et al., 1989 quienes usaron hematoprofirina y SDT para el sarcoma 180 de ratón y el hepatoma ascítico (AH) de rata que mostraron una relación entre la dosis y el ultrasonido, y microburbujas que causan cavitación que conduce al daño celular sin el uso de medicamentos. Este estudio también enfatizó la diferencia en eficacia entre líneas celulares a través de SDT 180 que tiene menos lisis en comparación con las células AH-130. Otro estudio de Hachimine et al. enfatizó la eficacia entre líneas celulares al examinar siete cánceres diferentes con 17 líneas celulares en total bajo el uso de DCPH-P-NA(I). [1] [20] Este estudio reveló que las líneas de cáncer de estómago y pulmón de MKN-28 y LU65A respectivamente tuvieron la tasa de supervivencia más alta, pero las líneas de cáncer de estómago y pulmón de RERFLC-KJ y MKN-45 respectivamente tuvieron las tasas de supervivencia más bajas. [20] [1] Otro estudio de Honda et al., con U937 y K562 mostró que la sonicación aumenta los niveles intracelulares de iones de calcio y disminuye la concentración de GSH respectivamente. [30] Esta mayor concentración de calcio juega un papel significativo en la muerte celular a través de la fragmentación del ADN y la disrupción de la membrana mitocondrial. [1] [30] Mientras que una concentración disminuida de GSH juega un papel significativo en permitir la formación de más radicales libres. [30] [1] Un estudio de Umemura et al., encontró que ATX-70 versus hematoporfirina ha aumentado la actividad citotóxica. [21] [1] La investigación actual generalmente se centra en el uso de modelos de xenoinjerto tumoral para determinar el efecto de la SDT en las células objetivo y la eficacia de la administración. [1]
Basándose en el estudio de Umemura et al. y ATX-70, se descubrió que 24 h después de la administración del sonosensibilizador había mejorado la eficacia cuando se aplicó ultrasonido en comparación con la administración inmediata. [21] [1] También se determinó que la mayoría de las frecuencias de ultrasonido oscilan entre 1-3 MHz y 0,5-4 W/cm^2. Las frecuencias más altas en valores como 20 W/cm^2 y 25 W/cm^2 dieron como resultado grandes lesiones necróticas. [73] [1] Esto estableció una relación entre la formulación del sonosensibilizador y la intensidad del ultrasonido hasta la necrosis. Otros estudios han seguido innovando en esto controlando el intervalo de ultrasonido del fármaco (DUI) para diferentes sonosensibilizadores con el fin de determinar el período de tiempo óptimo para aplicar el ultrasonido para una eficacia mejorada. [58] [1] Además, se ha demostrado que la SDT puede alterar la vasculatura circundante en los tumores. [1] [58] Esto se ha demostrado en estudios de Gao et al. con 5-ALA en líneas celulares endoteliales de la vena umbilical de ratones y humanos a través de la inhibición de la densidad de microvasos y la proliferación, migración e invasión celular. [58] [1]

Una de las muchas ventajas de la SDT en comparación con la PDT es la capacidad de la SDT de penetrar tumores sólidos ubicados profundamente, lo que permite un rango de tratamiento más amplio. [1] A pesar de este hecho, existen limitaciones de la SDT que deben superarse o tener componentes optimizados para expandir el efecto y la aplicación de la SDT. [31] La SDT permite la activación precisa de la terapia, pero está limitada en la administración y acumulación de la modalidad de administración para penetrar profundamente en el sitio del tumor deseado. [74] Esto a menudo se adapta a través de vasos de administración como nanopartículas o liposomas. [1] Sin embargo, la nanomedicina está limitada por la permeabilidad mejorada y el efecto de retención y lucha por administrarse en la abundancia dirigida dependiendo de la vesícula de administración. [31] [74] Esto se puede ver en nanopartículas que luchan con la administración no específica. La investigación futura se ha centrado en el desarrollo de nanopartículas de alta focalización y penetración para mejorar la administración y la farmacocinética. [75] [31] Debido a la naturaleza compleja de los tumores y sus microambientes, son difíciles de tratar con una sola terapia. Para mejorar la producción, a menudo baja, de especies reactivas de oxígeno para abordar el entorno hipóxico del tumor, la SDT se puede combinar con otras terapias, como la PDT, la quimioterapia y la inmunoterapia para mejorar los resultados del paciente. [2] [56] [54] [6] La SDT por sí sola no responde bien en entornos hipóxicos. Sin embargo, la terapia biorreductora podría usarse para reducir el impacto de las limitaciones de la SDT con respecto a la hipoxia en el tumor mientras se deja intacto el tejido sano/normal. [2] Los sonosensibilizadores también requieren altos niveles continuos de oxígeno para crear ROS, que no está fácilmente disponible dentro de un microambiente tumoral hipóxico. [31] Sin embargo, se han implementado estrategias como la suplementación y producción de oxígeno para suministrar el oxígeno requerido y mejorar la cavitación, y el agotamiento de glutatión para evitar la reducción de los radicales libres producidos junto con los sonosensibilizadores para suministrar el oxígeno requerido o reducir la función combativa. [76] [74] Además de su generación relativamente baja de especies reactivas de oxígeno, la SDT también puede causar la destrucción permanente de tejidos normales. Esta falta de selectividad es causada por la divergencia de ultrasonidos, lo que genera calor y cizallamiento que impactan en los tejidos no objetivo. [2] Aunque existen ventajas de los sonosensibilizadores orgánicos, como alta reproducibilidad, biocompatibilidad y producción de especies reactivas de oxígeno, también tienen limitaciones. [2]Los factores que limitan la traducción de sensibilizadores orgánicos a aplicaciones clínicas incluyen baja solubilidad en agua, sonotoxicidad y focalización, así como alta fototoxicidad . [2] Otras propiedades podrían promover la rápida depuración del fármaco, por lo que se utilizan varias nano y micropartículas para transportar el fármaco a la ubicación deseada. [2] Además, los sonosensibilizadores en SDT a menudo requieren una mayor dosis, y la relación entre la dosis terapéutica y la toxicidad de los sonosensibilizadores no se ha caracterizado adecuadamente junto con otras variables como el tipo de tejido y la presión acústica. [31] Los sensibilizadores inorgánicos producen especies reactivas de oxígeno, pero en concentraciones más bajas que las deseables para SDT, lo que limita su capacidad para ser utilizados en un entorno clínico. [2] Otro desafío se refleja en el trabajo in vitro e in vivo. Un ejemplo de esto se puede ver en un estudio que utiliza rosa de bengala, un tinte de xanteno. [1] Se encontró que era exitoso in vitro, pero in vivo mostró una eficacia significativamente menor debido al secuestro y la depuración del hígado. [1] Por último, no existen simulaciones computacionales estandarizadas actuales para predecir las características de diferentes sonosensibilizadores dentro del tejido, lo que proporcionaría una mayor comprensión de cómo pueden comportarse los sonosensibilizadores. [16]

La terapia de terapia de reemplazo hormonal (SDT) se ha investigado con mayor frecuencia para combatir cánceres y aterosclerosis, como cáncer de mama, cáncer de páncreas, cáncer de hígado y sarcomas espinales. [7] [3] [ 8] [9] [13] [12 ] [11] [10] [16] [15] [14] [77] Actualmente, no existen aplicaciones clínicas de la SDT aprobadas por la FDA. Sin embargo, para la PDT, Photofrin es una hematoporfirina aprobada por la FDA (PHOTOFRIN®). Sin embargo, la SDT se ha utilizado en un ensayo clínico en combinación con la PDT para evaluar la reducción del tamaño del tumor en pacientes con cáncer de mama. [1] Sin embargo, fue difícil determinar si la SDT, la PDT o la dosis del fármaco era el mecanismo principal del tratamiento. [1] Otro estudio de caso amplió esto al utilizar la SDT como un tratamiento independiente con una terapia hormonal con proteína Gc con el uso de 5-ALA o clorina e6 como sonosensibilizador. Se demostró que los marcadores tumorales disminuyeron significativamente durante el tratamiento. [1] [78]

La eficacia de la terapia sonodinámica como tratamiento del cáncer está respaldada por numerosos estudios in vitro e in vivo. [1] Sin embargo, son necesarios ensayos clínicos a gran escala para su aplicación en el ámbito clínico. Para mitigar las limitaciones mencionadas anteriormente, se están desarrollando nuevos sonosensibilizadores y la terapia sonodinámica se está combinando con otras terapias de formas novedosas. En particular, es necesario desarrollar sonosensibilizadores orgánicos con alta solubilidad en agua, alta sonotoxicidad, mayor capacidad para atacar tumores y baja fototoxicidad para mejorar la eficacia terapéutica de la terapia sonodinámica y permitir su uso para tratar el cáncer. [2] Además, aún no se han determinado los mecanismos por los cuales los sonosensibilizadores producen ROS tras la exposición a ultrasonidos, lo que reduce la capacidad de controlar su función y sus resultados. En última instancia, los efectos sinérgicos de combinar la terapia sonodinámica con otras terapias permitirían que cada una compense las limitaciones de la otra, mejorando su eficacia terapéutica y aumentando su capacidad para destruir tumores. [2]