18-Crown-6 es un compuesto orgánico con la fórmula [C 2 H 4 O] 6 y el nombre IUPAC de 1,4,7,10,13,16-hexaoxaciclooctadecano. Es un sólido cristalino higroscópico de color blanco con un punto de fusión bajo. [1] Al igual que otros éteres corona , el 18-crown-6 funciona como ligando para algunos cationes metálicos con una afinidad particular por los cationes de potasio ( constante de unión en metanol : 10 6 M −1 ). El grupo de puntos de 18-corona-6 es S 6 . El momento dipolar de 18-corona-6 depende del disolvente y de la temperatura. Por debajo de 25 °C, el momento dipolar de 18-corona-6 es 2,76 ± 0,06 D en ciclohexano y 2,73 ± 0,02 en benceno. [2] La síntesis de los éteres corona motivó la concesión del Premio Nobel de Química a Charles J. Pedersen .
Este compuesto se prepara mediante una síntesis de éter Williamson modificado en presencia de un catión plantilla: [3]
(CH 2 OCH 2 CH 2 Cl) 2 + (CH 2 OCH 2 CH 2 OH) 2 + 2 KOH → (CH 2 CH 2O ) 6 + 2KCl + 2H2O
También se puede preparar mediante oligomerización de óxido de etileno . [1] Puede purificarse por destilación , donde se hace evidente su tendencia a sobreenfriarse. 18-Crown-6 también se puede purificar mediante recristalización en acetonitrilo caliente . Inicialmente forma un solvato insoluble. [3] Se puede preparar un material rigurosamente seco disolviendo el compuesto en THF seguido de la adición de NaK para dar [K(18-corona-6)]Na, una sal alcalina . [4]
El análisis cristalográfico revela una molécula relativamente plana, pero donde los centros de oxígeno no están orientados en la geometría simétrica idealizada de 6 veces que generalmente se muestra. [5] La molécula sufre un cambio conformacional significativo tras la complejación.
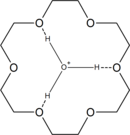
18-Crown-6 tiene una alta afinidad por el ion hidronio H 3 O + , ya que puede caber dentro del éter corona. Por tanto, la reacción de 18-corona-6 con ácidos fuertes da el catión . Por ejemplo, la interacción de 18-crown-6 con HCl gaseoso en tolueno con un poco de humedad da una capa de líquido iónico con la composición , de la cual se puede aislar el sólido en reposo. La reacción de la capa de líquido iónico con dos equivalentes molares de agua da el producto cristalino . [1] [6] [7]

18-Crown-6 se une a una variedad de cationes pequeños, utilizando los seis oxígenos como átomos donantes. Los éteres corona se pueden utilizar en el laboratorio como catalizadores de transferencia de fase . [8] Las sales que normalmente son insolubles en disolventes orgánicos se vuelven solubles con éter corona. [9] Por ejemplo, el permanganato de potasio se disuelve en benceno en presencia de 18-corona-6, dando el llamado "benceno púrpura", que puede usarse para oxidar diversos compuestos orgánicos. [1]
Varias reacciones de sustitución también se aceleran en presencia de 18-corona-6, que suprime el apareamiento iónico. [10] Los aniones se convierten así en nucleófilos desnudos . Por ejemplo, al utilizar 18-corona-6, el acetato de potasio es un nucleófilo más potente en disolventes orgánicos: [1]
La primera sal electruro que se examinó con cristalografía de rayos X , [Cs(18-corona-6) 2 ] + · e − , se sintetizó en 1983. Este sólido altamente sensible al aire y a la humedad tiene una estructura molecular tipo sándwich, donde el electrón queda atrapado dentro de cavidades reticulares casi esféricas. Sin embargo, la distancia más corta electrón-electrón es demasiado larga (8,68 Å) para que este material sea conductor de electricidad. [1]