(2 S ,4 R )-4-Hidroxiprolina , o L -hidroxiprolina ( C 5 H 9 O 3 N ), es un aminoácido , abreviado como Hyp u O , por ejemplo , en Protein Data Bank .
En 1902, Hermann Emil Fischer aisló la hidroxiprolina a partir de gelatina hidrolizada . En 1905, Hermann Leuchs sintetizó una mezcla racémica de 4-hidroxiprolina. [1]
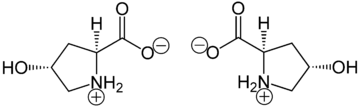
La hidroxiprolina se diferencia de la prolina por la presencia de un grupo hidroxilo (OH) unido al átomo de carbono gamma.
La hidroxiprolina se produce por hidroxilación del aminoácido prolina por la enzima prolil hidroxilasa después de la síntesis de proteínas (como una modificación postraduccional ). La reacción catalizada por la enzima tiene lugar en el lumen del retículo endoplasmático . Aunque no se incorpora directamente a las proteínas, la hidroxiprolina comprende aproximadamente el 4% de todos los aminoácidos que se encuentran en el tejido animal, una cantidad mayor que otros siete aminoácidos que se incorporan traduccionalmente. [2]
La hidroxiprolina es un componente principal de la proteína colágeno , [3] que comprende aproximadamente el 13,5% del colágeno de los mamíferos. La hidroxiprolina y la prolina desempeñan papeles clave para la estabilidad del colágeno. [4] Permiten la torsión aguda de la hélice de colágeno. [5] En la tríada canónica del colágeno Xaa-Yaa-Gly (donde Xaa y Yaa son cualquier aminoácido), una prolina que ocupa la posición Yaa se hidroxila para dar una secuencia Xaa-Hyp-Gly. Esta modificación del residuo de prolina aumenta la estabilidad de la triple hélice del colágeno . Inicialmente se propuso que la estabilización se debía a que las moléculas de agua formaban una red de enlaces de hidrógeno que unía los grupos hidroxilo del prolilo y los grupos carbonilo de la cadena principal. [6] Posteriormente se demostró que el aumento de la estabilidad se debe principalmente a efectos estereoelectrónicos y que la hidratación de los residuos de hidroxiprolina proporciona poca o ninguna estabilidad adicional. [7]
La hidroxiprolina se encuentra en pocas proteínas aparte del colágeno. Por este motivo, el contenido de hidroxiprolina se ha utilizado como indicador para determinar la cantidad de colágeno y/o gelatina . Sin embargo, las proteínas mamíferas elastina y argonauta 2 tienen dominios similares al colágeno en los que se forma la hidroxiprolina. Algunos venenos para caracoles, las conotoxinas , contienen hidroxiprolina, pero carecen de secuencias similares al colágeno. [2]
Se ha demostrado que la hidroxilación de la prolina está implicada en la selección de la subunidad alfa del factor inducible por hipoxia (HIF) ( HIF-1 alfa ) para su degradación por proteólisis . En condiciones de normoxia (condiciones normales de oxígeno), la proteína EGLN1 [1] hidroxila la prolina en la posición 564 del HIF-1 alfa, lo que permite la ubiquitinación por el supresor tumoral de von Hippel-Lindau (pVHL) y la posterior selección para la degradación por proteosoma . [8]
Las glicoproteínas ricas en hidroxiprolina (HRGP) también se encuentran en las paredes celulares de las plantas . [9] Estas hidroxiprolinas sirven como puntos de unión para las cadenas de glicano que se agregan como modificaciones postraduccionales . [9]
La hidroxilación de la prolina requiere ácido ascórbico ( vitamina C ). Los primeros efectos más evidentes (problemas gingivales y capilares) de la ausencia de ácido ascórbico en humanos provienen del defecto resultante en la hidroxilación de los residuos de prolina del colágeno , con una estabilidad reducida de la molécula de colágeno, causante del escorbuto .
También se ha demostrado un aumento de los niveles de hidroxiprolina en suero y orina en la enfermedad de Paget . [10]
El análisis de espectrometría de masas mostró una disminución en la cantidad de modificaciones postraduccionales de hidroxiprolina en el tejido no inflamado de pacientes con colitis ulcerosa en comparación con el tejido de donantes sin la enfermedad. [11]
También existen otras hidroxiprolinas en la naturaleza. Las más notables son la 2,3- cis- , 3,4- trans- y 3,4-dihidroxiprolina, que se encuentran en las paredes celulares de las diatomeas [12] y se postula que tienen un papel en la deposición de sílice . La hidroxiprolina también se encuentra en las paredes de los oomicetos , protistas similares a hongos relacionados con las diatomeas. [13] La (2 S ,4 S ) -cis -4-hidroxiprolina se encuentra en los péptidos cíclicos tóxicos de los hongos Amanita ( por ejemplo , faloidina ). [14]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )