En química orgánica , piranosa es un término colectivo para los sacáridos que tienen una estructura química que incluye un anillo de seis miembros que consta de cinco átomos de carbono y un átomo de oxígeno (un heterociclo ). Puede haber otros carbonos externos al anillo. El nombre deriva de su similitud con el heterociclo de oxígeno pirano , pero el anillo de piranosa no tiene dobles enlaces . Una piranosa en la que el −OH ( grupo hidroxilo ) anomérico en C(l) se ha convertido en un grupo OR se llama piranósido .
El anillo de piranosa se forma por la reacción del grupo hidroxilo en el carbono 5 (C-5) de un azúcar con el aldehído en el carbono 1. Esto forma un hemiacetal intramolecular . Si la reacción es entre el hidroxilo C-4 y el aldehído, se forma una furanosa . [1] La forma de piranosa es termodinámicamente más estable que la forma de furanosa, lo que se puede ver por la distribución de estas dos formas cíclicas en solución. [2]

Hermann Emil Fischer ganó el Premio Nobel de Química (1902) por su trabajo en la determinación de la estructura de las D - aldohexosas . [1] Sin embargo, las estructuras lineales de aldehído libre que Fischer propuso representan un porcentaje muy pequeño de las formas que adoptan los azúcares hexosas en solución. Fueron Edmund Hirst y Clifford Purves, en el grupo de investigación de Walter Haworth , quienes determinaron de manera concluyente que los azúcares hexosas forman preferentemente un anillo de piranosa, o de seis miembros. Haworth dibujó el anillo como un hexágono plano con grupos por encima y por debajo del plano del anillo: la proyección de Haworth . [3]
Un refinamiento adicional a la conformación de los anillos de piranosa llegó cuando Sponsler y Dore (1926) se dieron cuenta de que el tratamiento matemático de Sachse de los anillos de seis miembros podía aplicarse a su estructura de rayos X de la celulosa . [3] Se determinó que el anillo de piranosa está fruncido, para permitir que todos los átomos de carbono del anillo tengan una geometría tetraédrica cercana a la ideal.
Este fruncimiento conduce a un total de 38 conformaciones básicas de piranosa distintas : 2 sillas, 6 barcos, 6 barcos sesgados, 12 medias sillas y 12 envolturas. [4]

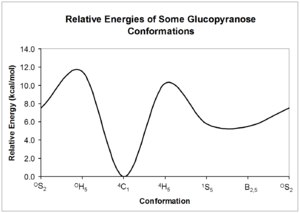
Estos conformadores pueden interconvertirse entre sí; sin embargo, cada forma puede tener una energía relativa muy diferente, por lo que puede existir una barrera significativa para la interconversión. La energía de estas conformaciones se puede calcular a partir de la mecánica cuántica ; se da un ejemplo de posibles interconversiones de glucopiranosa . [5]
Las conformaciones del anillo de piranosa son superficialmente similares a las del anillo de ciclohexano . Sin embargo, la nomenclatura específica de las piranosas incluye una referencia al oxígeno del anillo, y la presencia de hidroxilos en el anillo tiene efectos distintivos en su preferencia conformacional. También existen efectos conformacionales y estereoquímicos específicos del anillo de piranosa.

Para nombrar las conformaciones de la piranosa, primero se determina el confórmero. Los confórmeros comunes son similares a los que se encuentran en el ciclohexano , y estos forman la base del nombre. Las conformaciones comunes son silla (C), barco (B), sesgada (S), media silla (H) o envolvente (E). Luego se numeran los átomos del anillo; el carbono anomérico o hemiacetal siempre es 1. Los átomos de oxígeno en la estructura se denominan, en general, por el átomo de carbono al que están unidos en la forma acíclica, y se designan O. Luego:
Como lo muestran las energías estructurales relativas en el diagrama anterior, las estructuras en silla son la forma de carbohidrato más estable. Esta conformación relativamente definida y estable significa que los átomos de hidrógeno del anillo de piranosa se mantienen en ángulos relativamente constantes entre sí. La RMN de carbohidratos aprovecha estos ángulos diedros para determinar la configuración de cada uno de los grupos hidroxilo alrededor del anillo.