El Plasmodium malariae es un protozoo parásito que causa malaria en los seres humanos. Es una de las varias especies de parásitos Plasmodium que infectan a otros organismos como patógenos, entre los que se incluyen también Plasmodium falciparum y Plasmodium vivax , responsables de la mayoría de las infecciones por malaria . Se encuentra en todo el mundo y causa una denominada "malaria benigna", no tan peligrosa como la producida por P. falciparum o P. vivax . Los síntomas incluyen fiebres que se repiten en intervalos de aproximadamente tres días ( fiebre cuartana o malaria cuartana ), más largas que los intervalos de dos días (terciana) del otro parásito de la malaria.
La malaria ha sido reconocida por las civilizaciones griega y romana hace más de 2000 años, con diferentes patrones de fiebre descritos por los primeros griegos. [2] En 1880, Alphonse Laveran descubrió que el agente causal de la malaria es un parásito. [2] El trabajo detallado de Golgi en 1886 demostró que en algunos pacientes había una relación entre el ciclo de vida de 72 horas del parásito y los patrones de escalofríos y fiebre en el paciente. [2] La misma observación se encontró para parásitos con ciclos de 48 horas. [2] Golgi concluyó que debe haber más de una especie de parásito de la malaria responsable de estos diferentes patrones de infección. [2]

Cada año, aproximadamente 500 millones de personas en todo el mundo se infectarán con malaria. [4] De los infectados, aproximadamente dos millones morirán de la enfermedad. [5] La malaria es causada por seis especies de Plasmodium : Plasmodium falciparum , Plasmodium vivax , Plasmodium ovale curtisi , Plasmodium ovale wallikeri , Plasmodium malariae y Plasmodium knowlesi . [2] Se estima que en cualquier momento dado, 300 millones de personas están infectadas con al menos una de estas especies de Plasmodium , por lo que existe una gran necesidad de desarrollar tratamientos efectivos para disminuir las tasas anuales de mortalidad y morbilidad. [6]

P. malariae es una de las seis especies menos estudiadas que infectan a los humanos, en parte debido a su baja prevalencia y manifestaciones clínicas más leves en comparación con las otras especies. Está muy extendida en toda el África subsahariana , gran parte del sudeste asiático, Indonesia, en muchas de las islas del Pacífico occidental y en áreas de la cuenca del Amazonas de América del Sur. [5] En las regiones endémicas, la prevalencia varía de menos del 4% a más del 20%, [7] pero hay evidencia de que las infecciones por P. malariae están muy subnotificadas. [8]
Los Centros para el Control y Prevención de Enfermedades (CDC) tienen una aplicación que permite a las personas ver partes específicas del mundo y cómo se ven afectadas por el Plasmodium vivax y otros tipos del parásito Plasmodium . Se puede encontrar en el siguiente enlace: http://cdc.gov/malaria/map/index.html.
P. malariae puede infectar a varias especies de mosquitos y puede causar malaria en humanos. [2] P. malariae puede mantenerse con tasas de infección muy bajas en una población dispersa y móvil porque, a diferencia de otros parásitos Plasmodium , puede permanecer en un huésped humano durante un período prolongado de tiempo y seguir siendo infeccioso para los mosquitos. [8]
El vector de transmisión del parásito es el mosquito Anopheles hembra , pero se ha demostrado que muchas especies diferentes transmiten el parásito, al menos experimentalmente. [2] Collins y Jeffrey informan sobre más de treinta especies diferentes, que varían según la región geográfica. [2]
La información sobre el período prepatente, o el período de tiempo entre la infección del parásito y la manifestación de ese parásito dentro del cuerpo, de la malaria asociada a P. malariae es limitada, pero los datos sugieren que existe una gran variación, a menudo la duración depende de la cepa del parásito P. malariae . [2] Por lo general, el período prepatente varía de 16 a 59 días. [2]
Plasmodium malariae causa una infección crónica que en algunos casos puede durar toda la vida. El parásito P. malariae tiene varias diferencias entre él y los otros parásitos Plasmodium , una de ellas es que los recuentos máximos de parásitos suelen ser bajos en comparación con los de los pacientes infectados con P. falciparum o P. vivax. [2] La razón de esto posiblemente se pueda explicar por el menor número de merozoitos producidos por ciclo eritrocítico, el ciclo de desarrollo más largo de 72 horas (en comparación con el ciclo de 48 horas de P. vivax y P. falciparum ), la preferencia por el desarrollo en eritrocitos más viejos y el consiguiente desarrollo más temprano de la inmunidad por parte del huésped humano. [2] Otra característica definitoria de P. malariae es que las manifestaciones febriles del parásito son más moderadas en relación con las de P. falciparum y P. vivax y las fiebres muestran una periodicidad cuartana. [7] Junto con episodios de fiebre y síntomas clínicos más generales como escalofríos y náuseas, se ha documentado la presencia de edema y síndrome nefrótico en algunas infecciones por P. malariae . [2] Se ha sugerido que los complejos inmunes pueden causar daño glomerular estructural y que también puede ocurrir enfermedad renal. [2] Aunque P. malariae por sí solo tiene una baja tasa de morbilidad, contribuye a la morbilidad total causada por todas las especies de Plasmodium , como se manifiesta en las incidencias de anemia, baja tasa de natalidad y resistencia reducida a otras infecciones. [7]
Debido a la similitud en la apariencia de los patógenos, las infecciones por P. knowlesi suelen diagnosticarse erróneamente como infecciones por P. malariae . Por lo general, se requiere un análisis molecular para un diagnóstico preciso. [9]
El método preferible para el diagnóstico de P. malariae es a través del examen de frotis de sangre periférica teñidos con tinción de Giemsa. [2] Las técnicas de PCR también se utilizan comúnmente para confirmar diagnósticos, así como para separar infecciones mixtas por Plasmodium . [2] Sin embargo, incluso con estas técnicas, puede ser imposible diferenciar infecciones, como es el caso en áreas de América del Sur donde los humanos y los monos coexisten y P. malariae y P. brasilianum no son fácilmente distinguibles. [2]

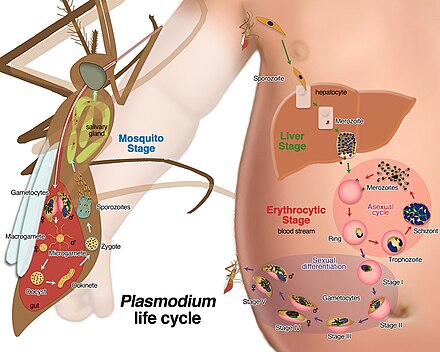
P. malariae es el único parásito de la malaria humana que causa fiebres que se repiten en intervalos de aproximadamente tres días (por lo tanto, ocurren cada cuatro días, una fiebre cuartana ), más largas que los intervalos de dos días ( terciana ) de los otros parásitos de la malaria. [10]
En la etapa hepática, se producen muchos miles de merozoitos en cada esquizonte. [2] A medida que se liberan los merozoitos, invaden los eritrocitos e inician el ciclo eritrocítico, donde el parásito digiere la hemoglobina para obtener aminoácidos para la síntesis de proteínas. [5]
La duración total del desarrollo intraeritrocítico es de aproximadamente 72 horas para P. malariae . [11]
En la etapa de esquizonte, después de la división esquizogónica, hay aproximadamente entre 6 y 8 células parásitas en el eritrocito. [11]
Tras el ciclo eritrocítico, que dura una media de setenta y dos horas, se liberan entre seis y catorce merozoitos que vuelven a invadir otros eritrocitos. [2] Finalmente, algunos de los merozoitos se transforman en micro o macrogametocitos. [2] Los dos tipos de gametocitos son absorbidos por el mosquito durante la alimentación y el ciclo se repite. [2] No existen reservorios animales para P. malariae.
Al igual que otros parásitos Plasmodium que infectan a los humanos , el Plasmodium malariae tiene ciclos de desarrollo distintos en el mosquito Anopheles y en el huésped humano. [2] El mosquito actúa como huésped definitivo y el huésped humano es el intermediario. [2] Cuando el mosquito Anopheles se alimenta de sangre de un individuo infectado, ingiere gametocitos de la persona infectada. [2] Pronto se produce un proceso conocido como exflagelación del microgametocito y se forman hasta ocho microgametos móviles. [2]
Después de la fertilización del macrogameto , se forma un oocineto móvil, que penetra la membrana peritrópica que rodea la sangre ingerida y viaja hasta la pared exterior del intestino medio del mosquito. [2] Luego, el ooquiste se desarrolla debajo de la membrana basal y después de un período de dos a tres semanas, se produce una cantidad variable de esporozoitos dentro de cada ooquiste. [2] La cantidad de esporozoitos que se producen varía con la temperatura y puede oscilar entre muchos cientos y unos pocos miles. [2] Finalmente, el ooquiste se rompe y los esporozoitos se liberan en el hemocele del mosquito. Luego, los esporozoitos son transportados por la circulación de la hemolinfa a las glándulas salivales, donde se concentran en las células acinares. [2] Una pequeña cantidad de esporozoitos se introducen en el conducto salival y se inyectan en la piel del humano mordido. [12] Esto posteriormente conduce al ciclo en el hígado humano. [2]
Los estadios anulares que se forman por la invasión de merozoitos liberados por la ruptura de esquizontes en estadio hepático son los primeros estadios que aparecen en la sangre. [2] Los estadios anulares crecen lentamente pero pronto llenan entre un cuarto y un tercio de la célula parasitada. [2] El pigmento aumenta rápidamente y el parásito a medio desarrollar puede tener entre 30 y 50 gránulos de color negro azabache. [2] El parásito cambia de forma a medida que crece y se extiende a través de la célula huésped para formar la forma de banda. [2]
P. vivax y P. ovale que permanecen en EDTA durante más de 30 minutos antes de realizar el frotis de sangre tendrán una apariencia muy similar a P. malariae , lo que es una razón importante para advertir al laboratorio inmediatamente cuando se extrae la muestra de sangre para que puedan procesarla tan pronto como llegue.
Microscópicamente, el glóbulo rojo parasitado (eritrocito) nunca está agrandado e incluso puede parecer más pequeño que el de los glóbulos rojos normales. El citoplasma no está decolorado y no se ven puntos en la superficie celular. La vacuola alimenticia es pequeña y el parásito es compacto. Las células rara vez albergan más de un parásito. Las formas en banda, donde el parásito forma una banda gruesa a lo ancho de la célula infectada, son características de esta especie (y algunos dirían que es diagnóstica). A menudo se ven grandes granos de pigmento palúdico en estos parásitos: más que en cualquier otra especie de Plasmodium , 8 merozoitos.
La falta de detección de algunas infecciones por P. malariae ha llevado a modificaciones de los cebadores específicos de la especie y a esfuerzos para desarrollar ensayos de PCR en tiempo real. [2] El desarrollo de un ensayo de este tipo ha incluido el uso de cebadores genéricos que se dirigen a una región altamente conservada de los genes 18S rRNA de las cuatro especies de Plasmodium que infectan a los humanos . [2] Se encontró que este ensayo es altamente específico y sensible. Aunque las pruebas serológicas no son lo suficientemente específicas para fines de diagnóstico, se pueden utilizar como herramientas epidemiológicas básicas. [2] La técnica de anticuerpos inmunofluorescentes (IFA) se puede utilizar para medir la presencia de anticuerpos contra P. malariae. . [2] Ha surgido un patrón en el que una infección de corta duración causa una respuesta inmune que disminuye rápidamente, pero tras la reinfección o recrudescencia, el nivel de IFA aumenta significativamente y permanece presente durante muchos meses o años. [5]
La creciente necesidad de identificar correctamente la infección por P. malariae se ve subrayada por su posible resistencia a los antipalúdicos. En un estudio de Müller-Stöver et al., los investigadores presentaron a tres pacientes que se encontraron infectados con el parásito después de tomar medicamentos antipalúdicos. [13] Dado el desarrollo preeritrocítico más lento y el período de incubación más largo en comparación con las otras especies de Plasmodium que causan malaria , los investigadores plantearon la hipótesis de que los antipalúdicos pueden no ser lo suficientemente efectivos contra las etapas preeritrocíticas de P. malariae. [13] Pensaron que puede ocurrir un mayor desarrollo de P. malariae cuando las concentraciones plasmáticas de los antipalúdicos disminuyen gradualmente después de tomar los medicamentos antipalúdicos. Según el Dr. William E. Collins del Centro para el Control de Enfermedades (CDC), la cloroquina es la más comúnmente utilizada para el tratamiento y no se ha encontrado evidencia de resistencia a este fármaco. [14] En ese caso, es posible que los resultados de Müller-Stöver et al. Se proporcionaron incidencias aisladas.
La vacuola alimentaria es el compartimento especializado que degrada la hemoglobina durante la etapa eritrocítica asexual del parásito. [6] Se da a entender que se pueden desarrollar tratamientos farmacológicos eficaces si se atacan las enzimas proteolíticas de la vacuola alimentaria. En un artículo publicado en 1997, Westling et al. [5] centraron su atención en la clase de enzimas endopeptidasa aspártica, llamadas simplemente plasmepsinas. Intentaron caracterizar la especificidad de las enzimas clonadas de P. vivax y P. malariae. Mediante estudios de especificidad de sustrato y análisis de inhibidores, se descubrió que las plasmepsinas para P. malariae y P. vivax mostraban menos especificidad que para P. falciparum. Desafortunadamente, esto significa que el desarrollo de un inhibidor selectivo para P. malariae puede resultar más complicado que el desarrollo de uno para P. falciparum. [5] Otro estudio de Bruce et al. [7] presentó pruebas de que puede haber un intercambio genético regular dentro de las poblaciones de P. malariae . Se aislaron y analizaron seis marcadores genéticos polimórficos de P. malariae en 70 muestras de infecciones por P. malariae adquiridas naturalmente en diferentes partes del mundo. Los datos mostraron un alto nivel de portación multigenotípica en humanos. [7]
Ambos experimentos ilustran que el desarrollo de opciones de vacunas resultará complicado, si no imposible. El Dr. William Collins duda de que alguien esté buscando actualmente posibles vacunas para P. malariae [14] y, dada la complejidad del parásito, se puede inferir por qué. Afirma que se llevan a cabo muy pocos estudios con este parásito [14] , tal vez como resultado de su baja morbilidad y prevalencia percibida. Collins cita las grandes restricciones de los estudios con chimpancés y monos como una barrera considerable [14] . Dado que se cree que el parásito Plasmodium brasilianium que infecta a los monos sudamericanos es una forma adaptada de P. malariae, más investigaciones con P. brasilianium pueden brindar información valiosa sobre P. malariae.
Un estudio reciente muestra que los parásitos de la malaria cuartana se intercambian fácilmente entre humanos y monos en América Latina. Por lo tanto, se puede plantear la hipótesis de que los hospedadores mamíferos carecen de especificidad y se puede considerar que la malaria cuartana es una verdadera antropozoonosis. [15]
El trabajo continuo con la plasmepsina asociada con P. malariae, plasmepsina 4, por parte del Profesor Ben Dunn y su equipo de investigación de la Universidad de Florida puede brindar esperanza para el control de la malaria a largo plazo en el futuro cercano. [16]
En 2017 se publicó el genoma completo. [17] Se puede acceder a las secuencias en geneDB.org y plasmoDB.org.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{citation}}: CS1 maint: varios nombres: lista de autores ( enlace )