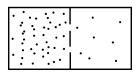
Expansión libre
Los gases reales experimentan un cambio de temperatura durante la expansión libre.
Para un gas ideal, la temperatura no cambia, y las condiciones antes y después de la expansión libre adiabática se satisfacen: Durante expansión libre, ningún trabajo es realizado por el gas.
Aunque sería difícil de lograr en la realidad, es instructivo imaginar una expansión libre causada por un pistón en movimiento más rápido que prácticamente cualquier átomo.
[1] De esta manera, para un gas ideal, el cambio en entropía es el mismo que para el efecto Joule-Thomson:[2] Se conoce que en una expansión libre no existe trabajo realizado pues: Además, se tiene que no existe cambio en la energía interna del gas, pues la energía interna del gas es función de la temperatura y la expansión libre es un proceso isotérmico: De esta manera, utilizando la identidad termodinámica
Es necesario recordar que a pesar de que el cambio de entropía del sistema se calcula utilizando una aproximación reversible, el proceso no puede ser tratado como reversible.