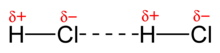Interacción dipolo-dipolo
Las fuerzas electrostáticas entre dos iones disminuyen de acuerdo con un factor 1/d2 a medida que aumenta su separación d. En cambio, las fuerzas dipolo varían según 1/d3 (d elevado a la tercera potencia) y sólo son eficaces a distancias muy cortas; además son fuerzas más débiles que en el caso ion-ion porque q+ y q- representan cargas parciales.Estas son ligeramente direccionales, es decir, al elevarse la temperatura, el movimiento traslacional, rotacional y vibracional de las moléculas aumenta y produce orientación más aleatoria entre ellas.En consecuencia, la fuerza de las interacciones dipolo-dipolo disminuye al aumentar la temperatura.Por otro lado, los átomos y las moléculas apolares, que no tienen un momento dipolar permanente, son polarizables, esto es, pueden formar dipolos eléctricos como reacción a un campo eléctrico cercano.El enlace entre un átomo o molécula apolar y una molécula dipolar se denomina dipolo permanente-dipolo inducido, y es de alcance aún más corto.