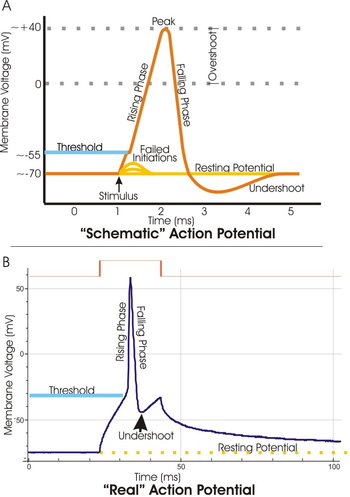
En electrofisiología , el potencial umbral es el nivel crítico al que se debe despolarizar un potencial de membrana para iniciar un potencial de acción . En neurociencia , los potenciales umbral son necesarios para regular y propagar la señalización tanto en el sistema nervioso central (SNC) como en el sistema nervioso periférico (SNP).
Muy a menudo, el potencial umbral es un valor de potencial de membrana entre –50 y –55 mV , [1] pero puede variar según varios factores. El potencial de membrana en reposo de una neurona (–70 mV) se puede alterar para aumentar o disminuir la probabilidad de alcanzar el umbral a través de iones de sodio y potasio . Una entrada de sodio en la célula a través de canales de sodio abiertos dependientes de voltaje puede despolarizar la membrana más allá del umbral y, por tanto, excitarla, mientras que una salida de potasio o una entrada de cloruro puede hiperpolarizar la célula e inhibir así que se alcance el umbral.
Los experimentos iniciales giraban en torno al concepto de que cualquier cambio eléctrico que se produzca en las neuronas debe ocurrir mediante la acción de iones. El físico-químico alemán Walther Nernst aplicó este concepto en experimentos para descubrir la excitabilidad nerviosa y concluyó que el proceso excitador local a través de una membrana semipermeable depende de la concentración iónica. Además, se demostró que la concentración de iones es el factor limitante en la excitación. Si se alcanzara la concentración adecuada de iones, sin duda se produciría excitación. [2] Esta fue la base para descubrir el valor umbral.
Además de reconstruir el potencial de acción en la década de 1950, Alan Lloyd Hodgkin y Andrew Huxley también pudieron determinar experimentalmente el mecanismo detrás del umbral de excitación. Se le conoce como modelo de Hodgkin-Huxley . Mediante el uso de técnicas de fijación de voltaje en un axón gigante de calamar, descubrieron que los tejidos excitables generalmente exhiben el fenómeno de que se debe alcanzar un cierto potencial de membrana para activar un potencial de acción. Dado que el experimento arrojó resultados mediante la observación de cambios de conductancia iónica, Hodgkin y Huxley utilizaron estos términos para discutir el potencial umbral. Inicialmente sugirieron que debía haber una discontinuidad en la conductancia del sodio o del potasio, pero en realidad ambas conductancias tendían a variar suavemente junto con el potencial de membrana. [3]
Pronto descubrieron que en el umbral de potencial, las corrientes de entrada y salida de iones de sodio y potasio, respectivamente, eran exactamente iguales y opuestas. A diferencia del potencial de membrana en reposo , las condiciones del potencial umbral exhibían un equilibrio de corrientes que eran inestables. La inestabilidad se refiere al hecho de que cualquier despolarización adicional activa aún más canales de sodio dependientes de voltaje, y la corriente despolarizante de sodio entrante supera la corriente saliente retardada de potasio. [4] En el nivel de reposo, por otro lado, las corrientes de potasio y sodio son iguales y opuestas de manera estable, donde no debería resultar un flujo repentino y continuo de iones. La base es que a un cierto nivel de despolarización, cuando las corrientes son iguales y opuestas de manera inestable, cualquier entrada adicional de carga positiva genera un potencial de acción. Este valor específico de despolarización (en mV) también se conoce como potencial umbral.
El valor umbral controla si los estímulos entrantes son suficientes o no para generar un potencial de acción. Se basa en un equilibrio de estímulos inhibidores y excitadores entrantes. Los potenciales generados por los estímulos son aditivos y pueden alcanzar un umbral en función de su frecuencia y amplitud. El funcionamiento normal del sistema nervioso central implica una suma de entradas sinápticas realizadas en gran medida en el árbol dendrítico de una neurona. Estos potenciales graduados locales, que se asocian principalmente con estímulos externos, alcanzan el segmento inicial axonal y se acumulan hasta que logran alcanzar el valor umbral. [5] Cuanto mayor es el estímulo, mayor es la despolarización o intento de alcanzar el umbral. La tarea de despolarización requiere varios pasos clave que dependen de factores anatómicos de la célula. Las conductancias iónicas involucradas dependen del potencial de membrana y también del tiempo después de que cambia el potencial de membrana. [6]
La bicapa de fosfolípidos de la membrana celular es, en sí misma, muy impermeable a los iones. La estructura completa de la membrana celular incluye muchas proteínas que están incrustadas en la bicapa lipídica o la atraviesan por completo. Algunas de esas proteínas permiten el paso altamente específico de iones, canales iónicos . Los canales de potasio de fuga permiten que el potasio fluya a través de la membrana en respuesta a la disparidad en las concentraciones de potasio dentro (alta concentración) y fuera de la célula (baja). La pérdida de cargas positivas (+) de los iones potasio (K+) del interior de la célula da como resultado un potencial negativo en comparación con la superficie extracelular de la membrana. [7] Una "fuga" mucho más pequeña de sodio (Na+) en la célula da como resultado que el potencial de reposo real, aproximadamente –70 mV, sea menos negativo que el potencial calculado para K+ solo, el potencial de equilibrio, aproximadamente –90 mV. [7] La ATPasa de sodio-potasio es un transportador activo dentro de la membrana que bombea potasio (2 iones) de regreso a la célula y sodio (3 iones) fuera de la célula, manteniendo las concentraciones de ambos iones y preservando la polarización del voltaje. .
Sin embargo, una vez que un estímulo activa los canales de sodio dependientes de voltaje para que se abran, los iones de sodio positivos inundan la célula y el voltaje aumenta. Este proceso también puede iniciarse mediante la unión de un ligando o neurotransmisor a un canal regulado por ligando . Hay más sodio fuera de la célula que dentro, y la carga positiva dentro de la célula impulsa la salida de iones de potasio a través de canales de potasio regulados por voltaje con rectificador retardado. Dado que los canales de potasio dentro de la membrana celular están retrasados, cualquier entrada adicional de sodio activa cada vez más canales de sodio dependientes de voltaje. La despolarización por encima del umbral produce un aumento en la conductancia del Na suficiente para que el movimiento de entrada de sodio inunde inmediatamente el movimiento de salida de potasio. [3] Si la entrada de iones de sodio no alcanza el umbral, entonces la conductancia del sodio no aumenta lo suficiente como para anular la conductancia del potasio en reposo. En ese caso, se observan oscilaciones del potencial de membrana por debajo del umbral en algún tipo de neuronas. Si tiene éxito, la entrada repentina de carga positiva despolariza la membrana y el potasio demora en restablecer o hiperpolarizar la célula. La entrada de sodio despolariza la célula en un intento de establecer su propio potencial de equilibrio (aproximadamente +52 mV) para hacer que el interior de la célula sea más positivo en relación con el exterior.
El valor del umbral puede variar según numerosos factores. Los cambios en las conductancias iónicas del sodio o del potasio pueden provocar un aumento o una disminución del valor del umbral. Además, el diámetro del axón, la densidad de los canales de sodio activados por voltaje y las propiedades de los canales de sodio dentro del axón afectan el valor umbral. [8] Normalmente, en el axón o la dendrita, hay pequeñas señales despolarizantes o hiperpolarizantes resultantes de un estímulo previo. La propagación pasiva de estas señales depende de las propiedades eléctricas pasivas de la célula. Las señales sólo pueden continuar a lo largo de la neurona para provocar un potencial de acción más abajo si son lo suficientemente fuertes como para superar la resistencia y capacitancia de la membrana celular. Por ejemplo, una neurona de gran diámetro tiene más canales iónicos en su membrana que una célula más pequeña, lo que da como resultado una menor resistencia al flujo de corriente iónica. La corriente se propaga más rápido en una célula con menos resistencia y es más probable que alcance el umbral en otras partes de la neurona. [3]
También se ha demostrado experimentalmente que el potencial umbral se adapta a cambios lentos en las características de entrada regulando la densidad de los canales de sodio e inactivando estos canales de sodio en general. La hiperpolarización por los canales de potasio rectificadores retardados provoca un período refractario relativo que hace mucho más difícil alcanzar el umbral. Los canales de potasio rectificadores retardados son responsables de la fase tardía de salida del potencial de acción, donde se abren con un estímulo de voltaje diferente en comparación con los canales de sodio de activación rápida. Rectifican o reparan el equilibrio de iones a través de la membrana abriendo y permitiendo que el potasio fluya a favor de su gradiente de concentración desde el interior hacia el exterior de la célula. También se cierran lentamente, lo que da como resultado un flujo saliente de carga positiva que excede el equilibrio necesario. Da como resultado un exceso de negatividad en la célula, lo que requiere un estímulo extremadamente grande y la despolarización resultante para provocar una respuesta.
Las técnicas de seguimiento de umbrales prueban la excitabilidad de los nervios y dependen de las propiedades de las membranas axonales y los sitios de estimulación. Son extremadamente sensibles al potencial de membrana y a los cambios en este potencial. Estas pruebas pueden medir y comparar un umbral de control (o umbral de reposo) con un umbral producido por un cambio en el entorno, por un impulso único precedente, un tren de impulsos o una corriente subumbral. [9] La medición de cambios en el umbral puede indicar cambios en el potencial de membrana, las propiedades axonales y/o la integridad de la vaina de mielina .
El seguimiento de umbrales permite que una computadora ajuste la fuerza de un estímulo de prueba para activar una fracción definida del potencial nervioso o muscular máximo. Un experimento de seguimiento de umbral consiste en la aplicación de un estímulo de 1 ms a un nervio en intervalos regulares. [10] El potencial de acción se registra después del impulso desencadenante. El estímulo se reduce automáticamente en pasos de un porcentaje determinado hasta que la respuesta cae por debajo del objetivo (generación de un potencial de acción). A partir de entonces, el estímulo aumenta o disminuye dependiendo de si la respuesta anterior fue menor o mayor que la respuesta objetivo hasta que se haya establecido un umbral de reposo (o control). Luego, la excitabilidad de los nervios se puede cambiar alterando el entorno nervioso o aplicando corrientes adicionales. Dado que el valor de una corriente umbral única proporciona poca información valiosa porque varía dentro y entre sujetos, son más útiles pares de mediciones de umbral, comparando el umbral de control con los umbrales producidos por refractariedad, supernormalidad, constante de tiempo de fuerza-duración o "electrotono umbral". en estudios científicos y clínicos. [11]
El seguimiento del umbral tiene ventajas sobre otras técnicas electrofisiológicas , como el método de estímulo constante. Esta técnica puede rastrear cambios de umbral dentro de un rango dinámico del 200% y, en general, brinda más información sobre las propiedades axonales que otras pruebas. [12] Además, esta técnica permite que a los cambios en el umbral se les dé un valor cuantitativo, que cuando se convierte matemáticamente en un porcentaje, se puede usar para comparar preparaciones de fibras individuales y multifibras, diferentes sitios neuronales y excitabilidad nerviosa en diferentes especies. [12]
Una técnica de seguimiento de umbral específica es el electrotono de umbral , que utiliza la configuración de seguimiento de umbral para producir corrientes despolarizantes o hiperpolarizantes subumbrales duraderas dentro de una membrana. Los cambios en la excitabilidad celular se pueden observar y registrar creando estas corrientes duraderas. La disminución del umbral es evidente durante la despolarización extensa y el aumento del umbral es evidente con la hiperpolarización extensa. Con la hiperpolarización, hay un aumento en la resistencia de la membrana internodal debido al cierre de los canales de potasio, y la trama resultante "se abre en abanico". La despolarización produce el efecto contrario, activando los canales de potasio, produciendo una trama que se "abanica". [13]
El factor más importante que determina el umbral de electrotono es el potencial de membrana, por lo que el umbral de electrotono también se puede utilizar como índice del potencial de membrana. Además, se puede utilizar para identificar características de afecciones médicas importantes comparando los efectos de esas afecciones en el umbral potencial con los efectos observados experimentalmente. Por ejemplo, la isquemia y la despolarización provocan el mismo efecto de "abanico" de las formas de onda electrotónicas. Esta observación lleva a la conclusión de que la isquemia puede deberse a una sobreactivación de los canales de potasio. [14]
El papel del potencial umbral ha sido implicado en un contexto clínico, concretamente en el funcionamiento del propio sistema nervioso así como en el sistema cardiovascular.
Una convulsión febril , o "ataque de fiebre", es una convulsión asociada con un aumento significativo de la temperatura corporal , que ocurre con mayor frecuencia en la primera infancia. Los episodios repetidos de convulsiones febriles infantiles se asocian con un mayor riesgo de epilepsia del lóbulo temporal en la edad adulta. [15]
Con el registro con pinza de parche , se replicó un estado análogo in vitro en neuronas corticales de rata después de la inducción de temperaturas corporales febriles; Se observó una disminución notable en el potencial umbral. El mecanismo de esta disminución posiblemente implica la supresión de la inhibición mediada por el receptor GABA B con una exposición excesiva al calor. [15]
Se han observado anomalías en la excitabilidad neuronal en pacientes con esclerosis lateral amiotrófica y diabetes . Si bien el mecanismo responsable en última instancia de la variación difiere entre las dos condiciones, las pruebas a través de una respuesta a la isquemia indican una resistencia similar, irónicamente, a la isquemia y las parestesias resultantes. Como la isquemia se produce por inhibición de la bomba de sodio-potasio, están implicadas anomalías en el potencial umbral. [12]
Desde la década de 1940, se ha establecido el concepto de despolarización diastólica, o "potencial de marcapasos"; este mecanismo es una característica distintiva del tejido cardíaco. [16] Cuando se alcanza el umbral y se activa el potencial de acción resultante, las interacciones producen un latido; sin embargo, cuando este latido del corazón ocurre en un momento irregular, puede resultar en una condición potencialmente grave conocida como arritmia .
Diversos fármacos pueden presentar como efecto secundario una prolongación del intervalo QT . La prolongación de este intervalo es resultado de un retraso en la inactivación de los canales de sodio y calcio; sin una inactivación adecuada del canal, el potencial umbral se alcanza prematuramente y, por tanto, tiende a producirse arritmia. [17] Estos medicamentos, conocidos como agentes proarrítmicos, incluyen antimicrobianos, antipsicóticos, metadona e, irónicamente, agentes antiarrítmicos . [18] El uso de tales agentes es particularmente frecuente en las unidades de cuidados intensivos, y se debe tener especial cuidado cuando los intervalos QT se prolongan en tales pacientes: las arritmias como resultado de intervalos QT prolongados incluyen las torsades de pointes o TdP, potencialmente fatales. [17]
La dieta puede ser una variable en el riesgo de arritmia. Los ácidos grasos poliinsaturados , que se encuentran en los aceites de pescado y en varios aceites vegetales, [19] desempeñan un papel en la prevención de arritmias. [20] Al inhibir la corriente de sodio dependiente del voltaje, estos aceites cambian el potencial umbral a un valor más positivo; por lo tanto, un potencial de acción requiere una mayor despolarización. [20] El uso clínicamente terapéutico de estos extractos sigue siendo objeto de investigación, pero se establece una fuerte correlación entre el consumo regular de aceite de pescado y una menor frecuencia de hospitalización por fibrilación auricular, una arritmia grave y cada vez más común. [21]