
La presión osmótica es la presión mínima que se debe aplicar a una solución para evitar el flujo de entrada de su disolvente puro a través de una membrana semipermeable . [1] También se define como la medida de la tendencia de una solución a absorber su disolvente puro por ósmosis . La presión osmótica potencial es la presión osmótica máxima que podría desarrollarse en una solución si estuviera separada de su disolvente puro por una membrana semipermeable.
La ósmosis se produce cuando dos soluciones que contienen diferentes concentraciones de soluto se separan mediante una membrana selectivamente permeable. Las moléculas de disolvente pasan preferentemente a través de la membrana desde la solución de baja concentración a la solución con mayor concentración de soluto. La transferencia de moléculas de disolvente continuará hasta que se alcance el equilibrio. [1] [2]

Jacobus van 't Hoff encontró una relación cuantitativa entre la presión osmótica y la concentración de soluto, expresada en la siguiente ecuación:
donde es la presión osmótica, i es el índice de van 't Hoff adimensional , c es la concentración molar del soluto, R es la constante del gas ideal y T es la temperatura absoluta (normalmente en kelvin ). Esta fórmula se aplica cuando la concentración del soluto es suficientemente baja como para que la solución pueda tratarse como una solución ideal . La proporcionalidad con la concentración significa que la presión osmótica es una propiedad coligativa . Nótese la similitud de esta fórmula con la ley de los gases ideales en la forma donde n es el número total de moles de moléculas de gas en el volumen V y n / V es la concentración molar de moléculas de gas. Harmon Northrop Morse y Frazer demostraron que la ecuación se aplicaba a soluciones más concentradas si la unidad de concentración era molal en lugar de molar ; [3] así que cuando se utiliza la molalidad esta ecuación se ha llamado ecuación de Morse .
Para soluciones más concentradas, la ecuación de van 't Hoff se puede extender como una serie de potencias en la concentración de soluto, c . En una primera aproximación,
donde es la presión ideal y A es un parámetro empírico. El valor del parámetro A (y de los parámetros de aproximaciones de orden superior) se puede utilizar para calcular los parámetros de Pitzer . Los parámetros empíricos se utilizan para cuantificar el comportamiento de soluciones de solutos iónicos y no iónicos que no son soluciones ideales en el sentido termodinámico.
La celda Pfeffer fue desarrollada para la medición de la presión osmótica.
La medición de la presión osmótica se puede utilizar para la determinación de pesos moleculares .
La presión osmótica es un factor importante que afecta a las células biológicas. [4] La osmorregulación es el mecanismo de homeostasis de un organismo para alcanzar el equilibrio en la presión osmótica.
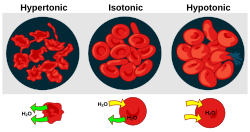
Cuando una célula biológica se encuentra en un ambiente hipotónico, el interior de la célula acumula agua, el agua fluye a través de la membrana celular hacia el interior de la célula, provocando su expansión. En las células vegetales , la pared celular restringe la expansión, lo que da lugar a una presión sobre la pared celular desde el interior denominada presión de turgencia . La presión de turgencia permite a las plantas herbáceas mantenerse erguidas. También es el factor determinante de cómo las plantas regulan la apertura de sus estomas . En las células animales, la presión osmótica excesiva puede dar lugar a citólisis debido a la ausencia de una pared celular.
La presión osmótica es la base del filtrado (" ósmosis inversa "), un proceso que se utiliza habitualmente en la purificación del agua . El agua que se va a purificar se coloca en una cámara y se somete a una cantidad de presión mayor que la presión osmótica ejercida por el agua y los solutos disueltos en ella. Parte de la cámara se abre a una membrana de permeabilidad diferencial que deja pasar las moléculas de agua, pero no las partículas de soluto. La presión osmótica del agua del océano es de aproximadamente 27 atm . La ósmosis inversa desaliniza el agua dulce del agua salada del océano .
Consideremos el sistema en el punto en el que ha alcanzado el equilibrio. La condición para ello es que el potencial químico del disolvente (ya que sólo él puede fluir libremente hacia el equilibrio) en ambos lados de la membrana sea igual. El compartimento que contiene el disolvente puro tiene un potencial químico de , donde es la presión. Por otro lado, en el compartimento que contiene el soluto, el potencial químico del disolvente depende de la fracción molar del disolvente, . Además, este compartimento puede asumir una presión diferente, . Por tanto, podemos escribir el potencial químico del disolvente como . Si escribimos , el balance del potencial químico es, por tanto:
Aquí, la diferencia de presión entre los dos compartimentos se define como la presión osmótica ejercida por los solutos. Al mantener la presión, la adición de soluto disminuye el potencial químico (un efecto entrópico ). Por lo tanto, la presión de la solución debe aumentarse en un esfuerzo por compensar la pérdida de potencial químico.
Para encontrar la presión osmótica, consideramos el equilibrio entre una solución que contiene soluto y agua pura.
Podemos escribir el lado izquierdo como:
donde es el coeficiente de actividad del disolvente. El producto también se conoce como la actividad del disolvente, que para el agua es la actividad del agua . La adición a la presión se expresa mediante la expresión de la energía de expansión:
donde es el volumen molar (m³/mol). Insertando la expresión presentada anteriormente en la ecuación del potencial químico para todo el sistema y reordenando se llega a:
Si el líquido es incompresible, el volumen molar es constante, y la integral se convierte en . Por lo tanto, obtenemos
El coeficiente de actividad es una función de la concentración y la temperatura, pero en el caso de mezclas diluidas, a menudo está muy cerca de 1,0, por lo que
La fracción molar del soluto, , es , por lo que se puede reemplazar por , que, cuando es pequeño, se puede aproximar por .
La fracción molar es . Cuando es pequeña, se puede aproximar por . Además, el volumen molar se puede escribir como volumen por mol, . Combinando estos, se obtiene lo siguiente.
En el caso de soluciones acuosas de sales, se debe tener en cuenta la ionización. Por ejemplo, 1 mol de NaCl se ioniza a 2 moles de iones.