Los tintes de azufre son los tintes más utilizados para el algodón en términos de volumen. Son económicos, generalmente tienen buena resistencia al lavado y son fáciles de aplicar. Los tintes de azufre son predominantemente negros, marrones y azul oscuro. [1] Los tintes de azufre rojos son desconocidos, aunque hay disponible un color rosa o escarlata más claro.
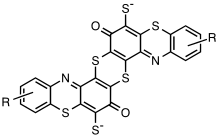
Los enlaces de azufre son parte integral del cromóforo en los tintes de azufre. Son compuestos organosulfurados que consisten en enlaces de sulfuro (–S–), disulfuro (–S–S–) y polisulfuro (–S n –) en anillos heterocíclicos. Presentan subunidades de tiazoles , tiazona, tiantreno y fenotiazonatioantrona. Al ser no iónicos, los tintes de azufre son insolubles en agua.
El teñido incluye varias etapas, a saber: reducción, teñido, lavado, oxidación, enjabonado y lavado final. El anión se desarrolla al reducir y solubilizarse en ebullición cuando muestra afinidad por la celulosa. El sulfuro de sodio (Na2S ) , el agente reductor y solubilizante, realiza tanto la reducción como la solubilización, produciendo tioles y luego la sal sódica de tioles o tiolatos, que son solubles en agua y sustantivos para la celulosa. La mayor tasa de agotamiento ocurre a 90-95 °C en presencia de electrolito. Los celulósicos teñidos exhiben un efecto de ablandamiento en el almacenamiento en atmósfera húmeda debido a la presencia de exceso de azufre libre. Se requiere un postratamiento con acetato de sodio para suprimirlo. El H2S liberado durante el teñido forma sulfuro metálico corrosivo. Esto restringe el uso de recipientes metálicos, excepto los hechos de acero inoxidable: [2]
El precursor de los tintes de azufre se atribuye al "Cachou de Laval", descubierto por Groissant y Bretonniere en 1873 y que se prepara tratando productos con lignina (como aserrín o paja) con fuentes de sulfuro (como hidróxido de sodio o sulfuro mezclado con azufre). Posteriormente, Henri-Raymond Vidal inventó los llamados negros Vidal en 1893 mediante reacciones de varios derivados de anilina con azufre. Estos experimentos demostraron que se podían producir fácilmente materiales de colores intensos combinando compuestos aromáticos y fuentes de azufre. [3]
El miembro más importante de la clase es el negro de azufre 1. Se produce por la reacción de 2,4-dinitrofenol y sulfuro de sodio en agua caliente. Como ocurre con muchos colorantes de azufre, los detalles de las reacciones químicas no se conocen bien. Se acepta que el sulfuro reduce los grupos nitro a derivados de anilina , que se cree que forman intermediarios que contienen indofenol y que se reticulan aún más por reacción con azufre. El resultado son especies insolubles de alto peso molecular. El negro de azufre 1 no se conoce bien y es probable que el material sea heterogéneo. Se especula que es un polímero que consta de subunidades de tiantreno y fenotiazina . Los denominados colorantes de cocción de azufre se producen a partir de derivados de 1,4-diaminobenceno y diaminotolueno . Se propone que estos colorantes constan de polímeros con subunidades de benzotiazol . Los miembros de la clase de colorantes de horneado de azufre son Azufre Naranja 1, Azufre Marrón 21 y Azufre Verde 12. [1]
Los colorantes de azufre son insolubles en agua. En presencia de un agente reductor y a un pH alcalino a una temperatura elevada de alrededor de 80 °C, las partículas de colorante se desintegran, se vuelven solubles en agua y, por lo tanto, pueden ser absorbidas por el tejido. El sulfuro de sodio o el hidrosulfuro de sodio son agentes reductores adecuados. La sal común facilita la absorción. Una vez que el tejido se retira de la solución de colorante, se deja reposar al aire, tras lo cual el colorante se regenera por oxidación. El colorante original regenerado es insoluble en agua. La oxidación también se puede realizar en el aire o con peróxido de hidrógeno o bromato de sodio en una solución ligeramente ácida.
La baja solubilidad en agua es la base de la buena solidez al lavado de estos tejidos teñidos. Estos tintes tienen una buena solidez del color en general , excepto con blanqueadores con cloro. Debido a que el tinte es insoluble en agua, no se destiñe al lavarse con agua y no mancha otras prendas. El tinte, sin embargo, puede tener poca solidez al frotamiento. Los tintes se blanquean con lejía de hipoclorito.
Debido a la naturaleza altamente contaminante del efluente del baño de tintura , los tintes de azufre se están eliminando gradualmente en Occidente, pero se utilizan a gran escala en China. [3] Los avances recientes en las tecnologías de teñido han permitido la sustitución de agentes reductores de sulfuro tóxicos. Ahora se utiliza glucosa en solución básica y están disponibles productos con bajo contenido de sulfuro y sin sulfuro. Los desarrollos futuros en el campo de la reducción de los niveles de tinte por medio de procesos electroquímicos son prometedores.