El taraxerol es un triterpenoide pentacíclico de origen natural . Existe en varias plantas superiores, entre ellas Taraxacum officinale ( Asteraceae ), Alnus glutinosa ( Betulaceae ), Litsea dealbata ( Lauraceae ), Skimmia spp. ( Rutaceae ), Dorstenia spp. ( Moraceae ), Maytenus spp. ( Celastraceae ) y Alchornea latifolia ( Euphobiaceae ). [1] El taraxerol recibió el nombre de "alnulina" cuando Zellner y Röglsperger lo aislaron por primera vez en 1923 de la corteza del aliso gris ( Alnus incana L.). También tenía el nombre de "skimmiol" cuando Takeda y Yosiki lo aislaron de Skimmia ( Rutaceae ). [2] Se sabe que una gran cantidad de plantas medicinales tienen este compuesto en sus hojas, raíces o aceite de semillas. [3]
El taraxerol es un oleanan-3-ol con un sustituyente alfa- metilo en la posición 13, un grupo metilo faltante en la posición 14 y un doble enlace entre 14 y 15. El estereoisómero biológico dominante en las hojas de las plantas y en los sedimentos tiene la configuración taraxer-14-en-3β-ol. El taraxerol es un isómero de doble enlace de la β-amirina , otro importante triterpenoide natural en las plantas superiores. Es un sólido incoloro a temperatura ambiente con un punto de fusión estimado de 283,50 °C y un punto de ebullición de 490,70 °C. Es prácticamente insoluble en agua y tiene una solubilidad de 9,552 × 10 −5 mg/L estimada a partir del coeficiente de reparto octanol-agua . [4]
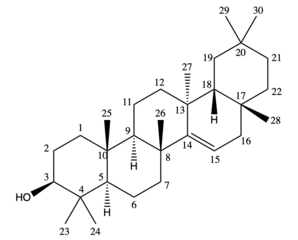
Si bien la síntesis de triterpenoides pentacíclicos en general ha demostrado ser un desafío, Ursprung et al. informaron sobre la síntesis parcial de 11,12-α-oxidotaraxerol, un derivado del epóxido del taraxereno, a partir de α- y β-amirina. La exposición de una solución etanólica de α- y β-amirina a la luz solar de verano durante 12 semanas produce un precipitado incoloro, y la saponificación del precipitado da 11,12-α-oxidotaraxerol. Alternativamente, el proceso podría acelerarse exponiendo la solución etanólica de β-amirina a la luz ultravioleta. En este caso, el precipitado puede recolectarse en menos de 3 semanas. [5]
Durante la diagénesis temprana , el taraxerol pierde su grupo hidroxilo y se transforma en taraxer-14-eno. El taraxer-14-eno puede sufrir una isomerización rápida para formar 18β-olean-12-eno, en el que el doble enlace puede migrar y formar una mezcla de olean-12-eno, olean-13(18)-eno y olean-18-eno. Los isómeros de oleaneno se forman rápidamente a partir de reordenamientos de taraxerol durante la diagénesis incluso en condiciones geotérmicas frías. [6] Una reducción adicional durante la catagénesis de los tres compuestos da predominantemente 18α-oleanano y su contraparte 18β-oleanano como un producto menor. El producto de reducción directa de taraxerol, el taraxerano, apenas está presente en sedimentos naturales. El oleanano parece ser el producto dominante como resultado del proceso de transformación. [7]

El taraxerol suele estar presente en cantidades menores en los extractos de plantas y puede utilizarse como biomarcador lipídico para las plantas terrestres. Sin embargo, en muchas especies de hojas de manglares, por ejemplo, Rhizophora mangle (mangle rojo) y Rhizophora racemosa , el taraxerol está presente en niveles muy altos. Por lo tanto, se utiliza en varios estudios como un indicador de la entrada de manglares. [1] [8] Dentro de las diferentes especies de manglares también existen diferencias de composición. Por ejemplo, Rhizophora mangle contiene altos niveles de taraxerol, β-amirina, germanicol y lupeol , Avicennia germinans (mangle negro) se compone principalmente de lupeol, betulina y β-sitosterol , y Laguncularia racemosa (mangle blanco) está marcada por grandes cantidades de lupeol y β-sitosterol. [9]

Rhizophora racemosa representa la especie dominante de manglares en África occidental ecuatorial y subecuatorial. Versteegh et al. analizaron los lípidos de las hojas de R. racemosa, así como los sedimentos superficiales y los núcleos de sedimentos de la cuenca de Angola y la cuenca del Cabo (Atlántico sudoriental) para evaluar la idoneidad de utilizar taraxerol como indicador de la contribución de los manglares a los sedimentos marinos. La hipótesis es que debería haber un "nivel base" de taraxerol en los sedimentos generales y niveles elevados en lugares donde Rhizophora tiene una contribución significativa.
El análisis sugiere que el taraxerol predomina en el interior y la composición total de las hojas de R. racemosa (7,7 mg/g de hoja). Como resultado, el aumento del nivel de taraxerol en relación con otros biomarcadores de plantas superiores en los sedimentos debería indicar cuándo y dónde Rhizophora contribuye sustancialmente. En la mayor parte del Atlántico SE, la relación taraxerol/ alcanos C 29 normales (nC 29 ) en los sedimentos superficiales es baja. Se observan relaciones altas en una zona a lo largo del talud continental, en la que los máximos siempre ocurren cerca de los árboles de manglares actuales en la costa. Este patrón corrobora firmemente el vínculo entre los altos niveles de taraxerol y el aporte de los ecosistemas de manglares. Este vínculo también está respaldado por una tendencia similar, aunque menos prominente, en los pólenes de Rhizophora .
El examen de los núcleos de sedimentos revela otras conexiones entre la población de manglares, los niveles de taraxerol y las condiciones climáticas. Una condición climática importante es la glaciación/desglaciación. Durante las desglaciaciones, cuando las tasas de aumento del nivel del mar superaban los 12 cm/100 años, las poblaciones de manglares no podían persistir debido a la falta de suministro de sedimentos. [10] Una vez que esta tasa se desaceleraba, las poblaciones de manglares podían expandirse nuevamente en los estuarios y deltas recientemente desarrollados. [11] [12] Sin embargo, los períodos de desarrollo de manglares y aumento de los niveles de taraxerol en la cuenca a veces no coinciden entre sí. En épocas de rápido aumento del nivel del mar, los depósitos de manglares costeros pueden transportarse a la cuenca, lo que resulta en un aumento en el aporte de taraxerol, mientras que el desarrollo de manglares en realidad ocurriría después. En algunos otros casos en los que la fluctuación en los niveles de taraxerol no estaba relacionada con los cambios del nivel del mar, también puede atribuirse a las variaciones climáticas locales en la temperatura y la humedad. [1]
Los métodos de análisis para la determinación y cuantificación del taraxerol incluyen la cromatografía de gases/espectroscopia de masas (GC/MS) y la cromatografía de capa fina de alto rendimiento (HPTLC). [13]
Existen varios procedimientos de tratamiento antes de pasar muestras de hojas o sedimentos que contienen taraxerol a un análisis GC/MS. Las muestras secas y molidas se saponifican con una base fuerte (por ejemplo, hidróxido de potasio ), se extraen en un disolvente polar (por ejemplo, diclorometano ), se separan en fracciones mediante cromatografía en columna y, finalmente, se derivatizan. Las opciones comunes para la derivatización incluyen N -metil- N- (trimetilsilil)trifluoroacetamida (MSTFA) y una mezcla de piridina y bis(trimetilsilil)trifluoroacetamida (BSTFA), las cuales tienen como objetivo convertir los grupos hidroxilo libres en éteres de trimetilsililo , lo que hace que las moléculas sean más no polares y, por lo tanto, más adecuadas para el análisis GC/MS. [1] [9] En GC/MS, el taraxerol tiene un pico característico con una relación masa-carga (m/z) de 204. [1]

Alternativamente, la determinación y cuantificación del taraxerol también se puede lograr con buena confiabilidad y reproducibilidad utilizando HPTLC. En este caso, se realiza un revelado ascendente lineal (por ejemplo, utilizando hexano y acetato de etilo (8:2 v/v) como fase móvil) en una cámara de vidrio de doble canal sobre placas de aluminio para TLC. La cuantificación se puede lograr mediante escaneo espectrodensitométrico a una longitud de onda de 420 nm. [13]
Se ha demostrado que el taraxerol, como muchos compuestos triterpenoides, posee efectos antiinflamatorios in vitro . Puede interrumpir la activación de las enzimas MAP3K7 (TAK1) , proteína quinasa B (PKB o Akt) y NF-κB . Al hacerlo, puede inhibir la expresión de mediadores proinflamatorios en micrófagos. [14]
El taraxerol también exhibe actividad anticancerígena. Las pruebas de carcinogénesis en dos etapas in vivo de tumores de piel de ratones mostraron que el taraxerol puede inhibir la inducción del antígeno temprano del virus de Epstein-Barr (EBV-EA) por el iniciador tumoral 7,12-dimetilbenz(a)antraceno (DMBA) y el promotor tumoral 12-O-tetradecanoilforbol-13-acetato (TPA). [15]
Además, el taraxerol puede inhibir la actividad de la acetilcolinesterasa (AChE) en el hipocampo de la rata . [16]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )