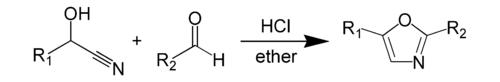
La síntesis de oxazol de Fischer es una síntesis química de un oxazol a partir de una cianhidrina y un aldehído en presencia de ácido clorhídrico anhidro . [1] Este método fue descubierto por Emil Fischer en 1896. [2] La cianhidrina en sí se deriva de un aldehído separado. Los reactivos de la propia síntesis del oxazol, la cianhidrina de un aldehído y el otro aldehído propiamente dicho, suelen estar presentes en cantidades equimolares. [3] Ambos reactivos suelen tener un grupo aromático , que aparece en posiciones específicas en el heterociclo resultante .
Un ejemplo más específico de la síntesis de oxazol de Fischer implica hacer reaccionar nitrilo de ácido mandélico con benzaldehído para dar 2,5-difeniloxazol. [4]
Fischer desarrolló la síntesis de oxazol de Fischer durante su estancia en la Universidad de Berlín . La síntesis de oxazol de Fischer fue una de las primeras síntesis desarrolladas para producir oxazoles 2,5-disustituidos. [4]
La síntesis de oxazol de Fischer es un tipo de reacción de deshidratación que puede ocurrir en condiciones suaves en una reordenación de los grupos que no parecería posible. La reacción se produce disolviendo los reactivos en éter seco y pasando a través de la solución cloruro de hidrógeno gaseoso seco . El producto, que es el oxazol 2,5-disustituido, precipita como hidrocloruro y puede convertirse en la base libre añadiendo agua o hirviéndolo con alcohol. [1]
Las cianhidrinas y aldehídos utilizados para la síntesis suelen ser aromáticos , sin embargo ha habido casos en los que se han utilizado compuestos alifáticos . El primer paso del mecanismo es la adición de HCl gaseoso a la cianohidrina 1 . La cianhidrina extrae el hidrógeno del HCl mientras que el ion cloruro ataca el carbono del grupo ciano . Este primer paso da como resultado la formación de un intermedio iminocloruro 2 , probablemente como la sal clorhidrato. Este intermedio luego reacciona con el aldehído ; el grupo hidroxilo de 2 extrae hidrógeno del nitrógeno, mientras que el par solitario de nitrógeno ataca el carbono carbonilo electrófilo del aldehído . El siguiente paso da como resultado un ataque de S N 2 seguido de la pérdida de agua para dar un intermedio de clorooxazolina 4 . Lo siguiente es la tautomerización del protón del anillo a . El último paso implica una eliminación y pérdida de una molécula de HCl para formar el producto 6 , que es el 2,5-diariloxazol. [4]
Los diarilazoles son motivos estructurales comunes tanto en productos naturales como en candidatos a fármacos, sin embargo, son difíciles de sintetizar. Los diariloxazoles generalmente se preparan mediante la síntesis de oxazol de Fischer o la síntesis de Robinson-Gabriel , donde el anillo de oxazol se construye mediante cualquiera de las síntesis. [5]
La síntesis de oxazol de Fischer también ha sido útil en la síntesis de 2-(4-bromofenil)5-feniloxazol a partir de benzaldehído cianohidrina y 4-bromobenzaldehído. Sin embargo, la cloración del anillo de oxazol produce 2,5-bis(4-bromofenil)-4-clorooxazol 7 junto con 2,5-bis(4-bromofenil)-4-oxazolidinona 8 . Este último compuesto es en general un subproducto . [6]

Otro ejemplo útil es la síntesis en dos pasos de halfordinol, un compuesto original de los alcaloides de Rutaceae . Los pasos iniciales siguen la síntesis de oxazol de Fischer, aunque la ciclación catalizada por ácido ocurre en dos pasos en lugar de uno, lo que asegura la formación del intermedio dicloro , evitando la formación del regioisómero . [4]

En investigaciones recientes, [ cita necesaria ] una reconsideración de la síntesis de oxazol de Fischer ha llevado a la síntesis de oxazoles 2,5-disustituidos a partir de aldehídos y α-hidroxiamidas. Sin embargo, a diferencia de la síntesis de oxazol de Fischer, el nuevo método no se limita a los diariloxazoles. [7]