
La comunidad microbiana de los respiraderos hidrotermales incluye todos los organismos unicelulares que viven y se reproducen en un área químicamente distinta alrededor de los respiraderos hidrotermales . Estos incluyen organismos en la estera microbiana , células flotantes libres o bacterias en una relación endosimbiótica con animales. Las bacterias quimiolitoautotróficas obtienen nutrientes y energía de la actividad geológica en los respiraderos hidrotermales para fijar el carbono en formas orgánicas. Los virus también son parte de la comunidad microbiana de los respiraderos hidrotermales y su influencia en la ecología microbiana en estos ecosistemas es un campo de investigación en auge. [1]
Los respiraderos hidrotermales se encuentran en los lugares donde las placas tectónicas se separan y se extienden. Esto permite que el agua del océano ingrese a la corteza terrestre, donde se calienta por el magma. El aumento de la presión y la temperatura obligan al agua a salir por estas aberturas y, al salir, el agua acumula minerales y sustancias químicas disueltas de las rocas con las que se encuentra. En general, existen tres tipos de respiraderos que se producen y todos se caracterizan por su temperatura y composición química. Los respiraderos difusos liberan agua clara, normalmente a una temperatura de hasta 30 °C. Los respiraderos de las fumarolas blancas emiten un agua de color lechoso entre 200 y 330 °C, y los respiraderos de las fumarolas negras generalmente liberan agua más caliente que los otros respiraderos, entre 300 y 400 °C. Las aguas de las fumarolas negras se oscurecen por los precipitados de sulfuro que se acumulan. [2] Debido a la ausencia de luz solar en estas profundidades oceánicas, la energía se obtiene mediante quimiosíntesis , donde las bacterias y arqueas simbióticas forman la base de la cadena alimentaria y son capaces de sustentar a una variedad de organismos como Riftia pachyptila y Alvinella pompejana. Estos organismos utilizan esta relación simbiótica para utilizar y obtener la energía química que se libera en estas áreas de ventilación hidrotermal. [3]

Aunque hay una gran variación en las temperaturas en la superficie del agua con los cambios estacionales en las profundidades de la termoclina , las temperaturas debajo de la termoclina y las aguas cercanas a las profundidades marinas son relativamente constantes. No hay cambios causados por efectos estacionales o cambios anuales. Estas temperaturas se mantienen en el rango de 0 a 3 °C con la excepción de las aguas que rodean inmediatamente los respiraderos hidrotermales, que pueden alcanzar hasta 407 °C. [4] [5] Estas aguas no pueden hervir debido a la alta presión a esas profundidades.
A medida que aumenta la profundidad, la alta presión comienza a hacer efecto. La presión aumenta unos 10 megapascales (MPa) por cada kilómetro de distancia vertical. Esto significa que la presión hidrostática puede alcanzar hasta 110 MPa en las profundidades de las fosas. [6]
La salinidad se mantiene relativamente constante en los mares profundos de todo el mundo, en 35 partes por mil. [4]
Aunque en el ambiente de los respiraderos hidrotermales hay muy poca luz, se han encontrado organismos fotosintéticos. [7] Sin embargo, la energía que utiliza la mayoría de los organismos proviene de la quimiosíntesis. Los organismos utilizan los minerales y los productos químicos que salen de los respiraderos.
Las condiciones extremas del entorno de los respiraderos hidrotermales hacen que las comunidades microbianas que habitan estas áreas deban adaptarse a ellas. Se sabe que los microbios que viven aquí son hipertermófilos, microorganismos que crecen a temperaturas superiores a los 90 °C. Estos organismos se encuentran en los lugares donde los fluidos de los respiraderos son expulsados y se mezclan con el agua circundante. Se cree que estos microbios hipertermófilos contienen proteínas que tienen una estabilidad prolongada a temperaturas más altas debido a interacciones intramoleculares, pero los mecanismos exactos aún no están claros. Los mecanismos de estabilización del ADN no son tan desconocidos y se cree que la desnaturalización del ADN se minimiza mediante altas concentraciones de sal, más específicamente Mg, K y PO4, que están altamente concentrados en los hipertermófilos. Junto con esto, muchos de los microbios tienen proteínas similares a las histonas que están unidas al ADN y pueden ofrecer protección contra las altas temperaturas. También se ha descubierto que los microbios mantienen relaciones simbióticas con otros organismos en el entorno de los respiraderos hidrotermales debido a su capacidad de tener un mecanismo de desintoxicación que les permite metabolizar las aguas ricas en sulfuro que de otro modo serían tóxicas para los organismos y los microbios. [8]
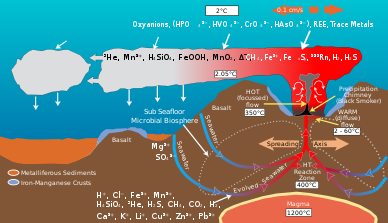
Las comunidades microbianas en los respiraderos hidrotermales median la transformación de energía y minerales producidos por la actividad geológica en material orgánico . La materia orgánica producida por bacterias autótrofas se utiliza luego para sustentar los niveles tróficos superiores . El fluido del respiradero hidrotermal y el agua del océano circundante son ricos en elementos como hierro , manganeso y varias especies de azufre, incluidos sulfuro , sulfito , sulfato y azufre elemental , de los cuales pueden derivar energía o nutrientes. [9] Los microbios obtienen energía oxidando o reduciendo elementos. Diferentes especies microbianas utilizan diferentes especies químicas de un elemento en sus procesos metabólicos . Por ejemplo, algunas especies de microbios oxidan sulfuro a sulfato y otra especie reducirá el sulfato a azufre elemental. Como resultado, una red de vías químicas mediadas por diferentes especies microbianas transforma elementos como carbono, azufre, nitrógeno e hidrógeno, de una especie a otra. Su actividad altera la composición química original producida por la actividad geológica del entorno del respiradero hidrotermal. [10]
La actividad geológica en los respiraderos hidrotermales produce una abundancia de compuestos de carbono . [11] Las columnas de los respiraderos hidrotermales contienen altas concentraciones de metano y monóxido de carbono , con una concentración de metano que alcanza 10 7 veces la del agua oceánica circundante. [11] [12] El agua oceánica profunda también es un gran reservorio de carbono y una concentración de especies de dióxido de carbono como CO2 disuelto y HCO3 − alrededor de 2,2 mM. [13] Los abundantes aceptores de carbono y electrones producidos por la actividad geológica sustentan un oasis de comunidades microbianas quimioautotróficas que fijan carbono inorgánico, como CO2 , utilizando energía de fuentes como la oxidación de azufre, hierro, manganeso, hidrógeno y metano. [11] Estas bacterias suministran una gran parte del carbono orgánico que sustenta la vida heterotrófica en los respiraderos hidrotermales. [14]
La fijación de carbono es la incorporación de carbono inorgánico a la materia orgánica. A diferencia de la superficie del planeta, donde la luz es una fuente importante de energía para la fijación de carbono, las bacterias quimiolitotróficas de los respiraderos hidrotermales dependen de la oxidación química para obtener la energía necesaria. [15] La fijación de CO2 se observa en miembros de Gammaproteobacteria , Campylobacterota , Alphaproteobacteria y miembros del dominio Archaea en los respiraderos hidrotermales. Cuatro vías metabólicas principales para la fijación de carbono que se encuentran en las comunidades de respiraderos microbianos incluyen el ciclo de Calvin-Benson-Bassham (CBB), el ciclo del ácido tricarboxílico reductor (rTCA), el ciclo del 3-hidroxipropionato (3-HP) y la vía reductora de la acetil coenzima A (acetil-CoA). [15]
El ciclo de Calvin-Benson-Bassham (CBB) es la vía de fijación de CO 2 más común que se encuentra entre los autótrofos. [16] La enzima clave es la ribulosa-1,5-bisfosfato carboxilasa/oxigenasa ( RuBisCO ). [15] Se ha identificado RuBisCO en miembros de la comunidad microbiana como Thiomicrospira, Beggiatoa , zetaproteobacterium y endosimbiontes gammaproteobacterianos de gusanos tubícolas , bivalvos y gasterópodos . [16]
El ciclo reductor de ácidos carboxílicos (rTCA) es la segunda vía de fijación de carbono más común en los respiraderos hidrotermales. [16] El ciclo rTCA es esencialmente un ciclo de Krebs o TCA inverso que utilizan los heterótrofos para oxidar la materia orgánica. Los organismos que utilizan el ciclo rTCA prefieren habitar zonas anóxicas en el sistema de respiraderos hidrotermales porque algunas enzimas en el ciclo rTCA son sensibles a la presencia de O 2. [15] Se encuentra en deltaproteobacterias reductoras de sulfato como algunos miembros de Desulfobacter , Aquificales y Aquifex y Thermoproteales . [15]
Las enzimas clave de los ciclos 3-HP y 3-HP/4-HB son la acetil-CoA/propionil-CoA carboxilasa, la malonil-CoA reductasa y la propionil-CoA sintasa. La mayoría de los organismos que utilizan esta vía son mixótrofos con la capacidad de utilizar carbono orgánico además de la fijación de carbono. [15]
La vía reductora del acetil CoA solo se ha encontrado en quimioautótrofos. Esta vía no requiere ATP ya que está directamente acoplada a la reducción de H 2 . Los organismos que se han encontrado con esta vía prefieren áreas ricas en H 2 . Las especies incluyen deltaproteobacterias como Dulfobacterium autotrophicum, acetógenos y arqueas metanogénicas . [15]
Los respiraderos hidrotermales producen grandes cantidades de metano que puede originarse tanto de procesos geológicos como biológicos. [11] [12] Las concentraciones de metano en las columnas de respiraderos hidrotermales pueden superar los 300 μM en concentración dependiendo del respiradero. En comparación, el fluido del respiradero contiene 10 6 – 10 7 veces más metano que el agua oceánica profunda circundante, del cual el metano varía entre 0,2-0,3 nM en concentración. [12] Las comunidades microbianas utilizan las altas concentraciones de metano como fuente de energía y fuente de carbono. [11] La metanotrofia , donde una especie utiliza metano como fuente de energía y carbono, se ha observado con la presencia de gammaproteobacteria en los linajes de Methylococcaceae . [16] Los metanótrofos convierten el metano en dióxido de carbono y carbono orgánico. [12] Por lo general, se caracterizan por la presencia de membranas intercelulares y se observó que los microbios con membranas intercelulares representan el 20% de la capa microbiana en los respiraderos hidrotermales. [11] [12]
La generación de energía a través de la oxidación del metano produce la siguiente mejor fuente de energía después de la oxidación del azufre. [11] Se ha sugerido que la oxidación microbiana facilita una rápida renovación en los respiraderos hidrotermales, por lo que gran parte del metano se oxida a poca distancia del respiradero. [12] En las comunidades de respiraderos hidrotermales, la oxidación aeróbica del metano se encuentra comúnmente en microbios endosimbióticos de animales del respiradero. [17] La oxidación anaeróbica del metano (AOM) generalmente está acoplada a la reducción de sulfato o Fe y Mn como aceptores terminales de electrones, ya que estos son más abundantes en los respiraderos hidrotermales. [12] [18] Se ha descubierto que la AOM es frecuente en sedimentos marinos en respiraderos hidrotermales [19] [18] y puede ser responsable de consumir el 75% del metano producido por el respiradero. [18] Las especies que realizan AOM incluyen Archaea del filo Thermoproteota (anteriormente Crenarchaeota ) y Thermococcus . [20]
La producción de metano a través de la metanogénesis puede ser a partir de la degradación de hidrocarburos , de la reacción del dióxido de carbono u otros compuestos como el formato . [17] Se puede encontrar evidencia de metanogénesis junto con AOM en sedimentos. [19] Se ha descubierto que los metanógenos termófilos crecen en columnas de respiraderos hidrotermales a temperaturas entre 55 °C y 80 °C. [21] Sin embargo, la metanogénesis autótropa realizada por muchas especies termófilas requiere H 2 como donante de electrones, por lo que el crecimiento microbiano está limitado por la disponibilidad de H 2. [21] [14] Los géneros de metanógenos termófilos que se encuentran en respiraderos hidrotermales incluyen Methanocaldococcus , Methanothermococcus y Methanococcus . [21]

Las comunidades microbianas en los respiraderos hidrotermales convierten el azufre, como el H2S producido por la actividad geológica , en otras formas, como sulfito , sulfato y azufre elemental , para obtener energía o asimilarlo en moléculas orgánicas . [10] El sulfuro es abundante en los respiraderos hidrotermales, con concentraciones de uno a decenas de mM, mientras que el agua del océano circundante generalmente solo contiene unos pocos nanomolares. [22]
Los compuestos de azufre reducido, como el H2S producido por los respiraderos hidrotermales, son una fuente importante de energía para el metabolismo del azufre en los microbios. [11] La oxidación de compuestos de azufre reducido en formas como sulfito , tiosulfato y azufre elemental se utiliza para producir energía para el metabolismo de los microbios, como la síntesis de compuestos orgánicos a partir de carbono inorgánico . [10] Las principales vías metabólicas utilizadas para la oxidación del azufre incluyen la vía SOX y la oxidación disimilatoria. La vía Sox es una vía multienzimática capaz de oxidar sulfuro, sulfito, azufre elemental y tiosulfato a sulfato. [ 10] La oxidación disimilatoria convierte el sulfito en azufre elemental. [9] Las especies oxidantes de azufre incluyen los géneros de Thiomicrospira , Halothiobacillus , Beggiatoa , Persephonella y Sulfurimonas . Las especies simbióticas de la clase Gammaproteobacteria y la phlym Campylobacterota también pueden oxidar el azufre. [10]
La reducción de azufre utiliza el sulfato como aceptor de electrones para la asimilación de azufre . Los microbios que realizan la reducción de sulfato suelen utilizar hidrógeno , metano o materia orgánica como donante de electrones . [18] [23] La oxidación anaeróbica del metano (AOM) a menudo utiliza el sulfato como aceptor de electrones. [18] Este método es favorecido por los organismos que viven en áreas altamente anóxicas del respiradero hidrotermal, [23] por lo tanto, son uno de los procesos predominantes que ocurren dentro de los sedimentos. [14] Se han identificado especies que reducen el sulfato en Archaea y miembros de Deltaproteobacteria como Desulfovibrio , Desulfobulbus , Desulfobacteria y Desulfuromonas en respiraderos hidrotermales. [23]

Las aguas profundas del océano contienen la mayor reserva de nitrógeno disponible para los respiraderos hidrotermales, con alrededor de 0,59 mM de gas nitrógeno disuelto. [24] [25] El amonio es la especie dominante de nitrógeno inorgánico disuelto y puede producirse mediante la mezcla de masas de agua debajo de los respiraderos hidrotermales y descargarse en los fluidos de los respiraderos. [25] Las cantidades de amonio disponible varían entre respiraderos dependiendo de la actividad geológica y la composición microbiana. [25] Las concentraciones de nitrato y nitrito se agotan en los respiraderos hidrotermales en comparación con el agua de mar circundante. [24]
El estudio del ciclo del nitrógeno en las comunidades microbianas de los respiraderos hidrotermales aún requiere una investigación más exhaustiva. [24] Sin embargo, los datos isotópicos sugieren que los microorganismos influyen en las cantidades y composiciones de nitrógeno inorgánico disuelto, y es probable que todas las vías del ciclo del nitrógeno se encuentren en los respiraderos hidrotermales. [25] La fijación biológica del nitrógeno es importante para proporcionar algo del nitrógeno biológicamente disponible al ciclo del nitrógeno, especialmente en los respiraderos hidrotermales no sedimentados. [24] El nitrógeno es fijado por muchos microbios diferentes, incluidos los metanógenos de los órdenes Methanomicrobiales , Methanococcales y Methanobacteriales . [24] Se ha descubierto que los microbios termófilos pueden fijar el nitrógeno a temperaturas más altas, como 92 °C. [24] La fijación del nitrógeno puede ser especialmente frecuente en tapetes microbianos y material particulado donde los niveles biológicamente disponibles de nitrógeno son bajos, debido a la alta densidad de microbios y al entorno anaeróbico que permiten la función de la nitrogenasa , una enzima fijadora de nitrógeno. [24] También se ha detectado evidencia de asimilación , nitrificación , desnitrificación , anammox , mineralización y reducción disimilatoria de nitrato a amonio . [25] Por ejemplo, las bacterias oxidantes de azufre como las especies de Begiatoa realizan la desnitrificación y reducen el nitrato para oxidar H2S . [ 24] La asimilación de nitrato la realizan especies simbióticas del gusano tubícola Riftia pachyptila . [24]
Las bacterias más abundantes en los respiraderos hidrotermales son las quimiolitotróficas. Estas bacterias utilizan especies químicas reducidas, con mayor frecuencia azufre, como fuentes de energía para reducir el dióxido de carbono a carbono orgánico. [11] La abundancia de quimiolitotróficas en un entorno de respiradero hidrotermal está determinada por las fuentes de energía disponibles; los respiraderos de diferentes temperaturas tienen diferentes concentraciones de nutrientes, lo que sugiere una gran variación entre respiraderos. En general, se encuentran grandes poblaciones microbianas en columnas de agua de respiraderos cálidos (25 °C), las superficies expuestas a columnas de respiraderos cálidos y en tejidos simbióticos dentro de ciertos invertebrados de respiraderos en las proximidades del respiradero. [11]
Estas bacterias utilizan diversas formas de azufre disponible (S −2 , S 0 , S 2 O 3 −2 ) en presencia de oxígeno. Son la población predominante en la mayoría de los respiraderos hidrotermales porque su fuente de energía está ampliamente disponible y las tasas de quimiosíntesis aumentan en condiciones aeróbicas. Las bacterias en los respiraderos hidrotermales son similares a los tipos de bacterias de azufre que se encuentran en otros entornos ricos en H 2 S, excepto que Thiomicrospira ha reemplazado a Thiobacillus. Otras especies comunes son Thiothrix y Beggiatoa, que es de particular importancia debido a su capacidad para fijar nitrógeno. [11]
El metano es una fuente sustancial de energía en ciertas fuentes hidrotermales, pero no en otras: el metano es más abundante en fuentes cálidas (25 °C) que el hidrógeno. [11] Existen muchos tipos de bacterias metanotróficas, que requieren oxígeno y fijan CH 4 , CH 3 NH 2 y otros compuestos C 1 , incluidos CO 2 y CO, si están presentes en el agua de las fuentes. [11] Este tipo de bacterias también se encuentran en el trofosoma de Riftia , lo que indica una relación simbiótica. [11] Aquí, las bacterias oxidantes de metano se refieren a los metanótrofos , que no son lo mismo que los metanógenos : Methanococcus y Methanocaldococcus jannaschii son ejemplos de metanógenos, [11] que se encuentran en fuentes hidrotermales; mientras que Methylocystaceae son metanótrofos, que también se han descubierto en comunidades de fuentes hidrotermales. [26]
Se sabe poco acerca de los microbios que utilizan hidrógeno como fuente de energía, sin embargo, los estudios han demostrado que son aeróbicos y también simbióticos con Riftia (ver más abajo). [11] [27] Estas bacterias son importantes en la producción primaria de carbono orgánico porque el H 2 producido geotérmicamente se absorbe para este proceso. [11] Las bacterias oxidantes de hidrógeno y desnitrificantes pueden ser abundantes en los respiraderos donde el agua de mar del fondo que contiene NO 3 − se mezcla con el fluido hidrotermal. [11] Desulfonauticus submarinus es un hidrogenótrofo que reduce los compuestos de azufre en respiraderos cálidos y se ha encontrado en gusanos tubícolas R. pachyptila y Alvinella pompejana. [28]
Estas bacterias se encuentran comúnmente en depósitos de hierro y manganeso en superficies expuestas intermitentemente a columnas de agua hidrotermal y de fondo marino. Sin embargo, debido a la rápida oxidación de Fe2 + en aguas neutras y alcalinas (es decir, agua dulce y agua de mar), las bacterias responsables de la deposición oxidativa de hierro se encontrarían más comúnmente en aguas ácidas. [11] Las bacterias oxidantes de manganeso serían más abundantes en agua dulce y agua de mar en comparación con las bacterias oxidantes de hierro debido a la mayor concentración de metal disponible. [11]
La quimiosíntesis simbiótica es un proceso importante para las comunidades de los respiraderos hidrotermales. [11] En los respiraderos cálidos, los simbiontes comunes para las bacterias son las almejas de aguas profundas, Calpytogena magnifica , mejillones como Bathyomodiolus thermophilus y gusanos tubícolas pogonóforos, Riftia pachyptila y Alvinella pompejana . [11] [27] [ ¿ fuente autopublicada? ] [28] El trofosoma de estos animales son órganos específicos para simbiontes que contienen moléculas valiosas para la quimiosíntesis. Estos organismos se han vuelto tan dependientes de sus simbiontes que han perdido todas las características morfológicas relacionadas con la ingestión y la digestión, aunque las bacterias reciben H 2 S y O 2 libre . [11] Además, se han aislado bacterias oxidantes de metano de C. magnifica y R. pachyptila, lo que indica que la asimilación de metano puede tener lugar dentro del trofosoma de estos organismos. [9]
Para ilustrar la increíble diversidad de fuentes hidrotermales, la lista que figura a continuación es una representación acumulativa de los filos y géneros bacterianos, en orden alfabético. Como se muestra, las proteobacterias parecen ser el filo más dominante presente en las fuentes hidrotermales de aguas profundas.
Las comunidades microbianas que habitan las chimeneas de los respiraderos hidrotermales de las profundidades marinas parecen estar altamente enriquecidas en genes que codifican enzimas empleadas en la reparación de errores de apareamiento del ADN y la recombinación homóloga . [29] Este hallazgo sugiere que estas comunidades microbianas han desarrollado amplias capacidades de reparación del ADN para hacer frente a las condiciones extremas de daño del ADN en las que existen. [29]

Los virus son la forma de vida más abundante en el océano y albergan la mayor reserva de diversidad genética. [30] Como sus infecciones suelen ser fatales, constituyen una fuente importante de mortalidad y, por lo tanto, tienen una influencia generalizada en los procesos oceanográficos biológicos, la evolución y el ciclo biogeoquímico dentro del océano. [31] Sin embargo, se han encontrado pruebas que indican que los virus que se encuentran en hábitats de respiraderos han adoptado una estrategia evolutiva más mutualista que parasitaria para sobrevivir al entorno extremo y volátil en el que existen. [32]
Se ha descubierto que los respiraderos hidrotermales de aguas profundas tienen una gran cantidad de virus, lo que indica una alta producción viral. [33] Las muestras de los respiraderos hidrotermales Endeavour frente a la costa sudoeste de Columbia Británica mostraron que las fumarolas negras de ventilación activa tenían abundancias virales de 1,45×10 5 a 9,90×10 7 por ml, con una caída en la abundancia encontrada en la columna de ventilación hidrotermal (3,5×10 6 por ml) y fuera del sistema de ventilación (2,94×10 6 por ml). La alta densidad de virus y, por lo tanto, de producción viral (en comparación con las aguas profundas circundantes) implica que los virus son una fuente importante de mortalidad microbiana en los respiraderos. [33] Al igual que en otros entornos marinos, los virus hidrotermales de aguas profundas afectan la abundancia y diversidad de procariotas y, por lo tanto, impactan el ciclo biogeoquímico microbiano al lisar a sus huéspedes para replicarse. [34]
Sin embargo, en contraste con su papel como fuente de mortalidad y control de la población, también se ha postulado que los virus mejoran la supervivencia de los procariotas en ambientes extremos, actuando como reservorios de información genética. Por lo tanto, se cree que las interacciones de la virosfera con microorganismos bajo estrés ambiental ayudan a la supervivencia de los microorganismos a través de la dispersión de genes del huésped mediante la transferencia horizontal de genes . [35]
Cada segundo, "se produce en el océano aproximadamente el mismo número de infecciones que Avogadro , y cada una de esas interacciones puede dar lugar a la transferencia de información genética entre el virus y el huésped". — Curtis Suttle [36]
Los fagos templados (aquellos que no causan lisis inmediata) a veces pueden conferir fenotipos que mejoran la aptitud en procariotas [7] El ciclo de vida lisogénico puede persistir de manera estable durante miles de generaciones de bacterias infectadas y los virus pueden alterar el fenotipo del huésped al habilitar genes (un proceso conocido como conversión lisogénica ) que, por lo tanto, puede permitir que los huéspedes se adapten a diferentes entornos. [37] Los beneficios a la población huésped también pueden conferirse mediante la expresión de fenotipos que mejoran la aptitud codificados por fagos. [38]

Una revisión del trabajo viral en respiraderos hidrotermales publicada en 2015 afirmó que los respiraderos albergan una proporción significativa de huéspedes lisogénicos y que una gran proporción de virus son templados, lo que indica que los entornos de los respiraderos pueden proporcionar una ventaja al profago. [39]
Un estudio de interacciones entre virus y hospedadores en ambientes de respiraderos hidrotermales de flujo difuso descubrió que la alta incidencia de hospedadores lisogénicos y grandes poblaciones de virus templados era única en su magnitud y que estos virus probablemente son críticos para la ecología de los sistemas de los procariotas. El análisis genético del mismo estudio descubrió que el 51% de las secuencias del metagenoma viral eran desconocidas (carecían de homología con los datos secuenciados), con una alta diversidad en los ambientes de los respiraderos pero una diversidad menor para sitios de respiraderos específicos, lo que indica una alta especificidad para los objetivos virales. [38]
Un análisis metagenómico de los viromas de los respiraderos hidrotermales de aguas profundas mostró que los genes virales manipulaban el metabolismo bacteriano , participando en vías metabólicas y formando vías ramificadas en el metabolismo microbiano que facilitaban la adaptación al entorno extremo. [40]
Un ejemplo de esto se asoció con la bacteria consumidora de azufre SUP05. Un estudio encontró que 15 de 18 genomas virales secuenciados a partir de muestras de columnas de ventilación contenían genes estrechamente relacionados con una enzima que los quimiolitoautótrofos SUP05 utilizan para extraer energía de los compuestos de azufre. Los autores concluyeron que dichos genes de fagos ( genes metabólicos auxiliares ) que son capaces de mejorar el metabolismo de oxidación del azufre en sus huéspedes podrían proporcionar ventajas selectivas a los virus (infección y replicación continuas). [41] La similitud en los genes virales y SUP05 para el metabolismo del azufre implica un intercambio de genes en el pasado y podría implicar a los virus como agentes de la evolución. [42]
Otro estudio metagenómico descubrió que los genes virales tenían proporciones relativamente altas de genes metabólicos, de vitaminas y de cofactores , lo que indica que los genomas virales codifican genes metabólicos auxiliares. Junto con las observaciones de una alta proporción de virus lisogénicos, esto indica que los virus son seleccionados para ser provirus integrados en lugar de virus flotantes libres y que los genes auxiliares pueden expresarse para beneficiar tanto al huésped como al virus integrado. Los virus mejoran la aptitud al impulsar el metabolismo u ofrecer una mayor flexibilidad metabólica a sus huéspedes. La evidencia sugiere que las estrategias evolutivas virales de las fuentes hidrotermales de aguas profundas promueven la integración prolongada del huésped, lo que favorece una forma de mutualismo en lugar del parasitismo clásico. [32]
Como los respiraderos hidrotermales son salidas [ aclaración necesaria ] para el material del subsuelo marino, es probable que también exista una conexión entre los virus de los respiraderos y los de la corteza. [39]