La reacción de alquilación de hidrazona Enders SAMP/RAMP es una reacción asimétrica de formación de enlaces carbono-carbono facilitada por auxiliares quirales de pirrolidina . Fue iniciado por EJ Corey y Dieter Enders en 1976, [1] y fue desarrollado aún más por Enders y su grupo. [2] Este método suele ser una secuencia de tres pasos. El primer paso es formar la hidrazona entre ( S )-1-amino-2-metoximetilpirrolidina (SAMP) o ( R )-1-amino-2-metoximetilpirrolidina (RAMP) y una cetona o aldehído . Posteriormente, la hidrazona es desprotonada por diisopropilamida de litio (LDA) para formar un azaenolato , que reacciona con haluros de alquilo u otros electrófilos adecuados para dar especies de hidrazona alquiladas con la generación simultánea de un nuevo centro quiral . Finalmente, la cetona o aldehído alquilado se puede regenerar mediante ozonólisis o hidrólisis . [3]

Esta reacción es una técnica útil para la α-alquilación asimétrica de cetonas y aldehídos, que son intermedios sintéticos comunes para productos naturales de interés medicinal y otros compuestos orgánicos relacionados . Estos productos naturales incluyen (-)-C10-desmetil arteannuin B, el análogo estructural de la artemisinina antipalúdica , [4] el metabolito polipropionato (-)-denticulatina A y B aislado de Siphonaria denticulata , [5] ácido zaragozic A, un potente inhibidor de síntesis de esteroles , [6] y epotilona A y B, que han demostrado ser fármacos anticancerígenos muy eficaces. [7]
La formación regioselectiva y estereoselectiva de enlaces carbono-carbono adyacentes al grupo carbonilo es un procedimiento importante en química orgánica. La reacción de alquilación de enolatos ha sido el foco principal del campo. Tanto AG Myers como DA Evans desarrollaron reacciones de alquilación asimétricas para enolatos. [8] [9]

El inconveniente aparente de las reacciones de alquilación de enolatos es la sobrealquilación, incluso si se controlan cuidadosamente la cantidad de base añadida para la enolización así como la temperatura de reacción. La formación de cetena durante el proceso de desprotonación de sustratos que poseen oxazolidinona de Evans es también una reacción secundaria principal de las reacciones de alquilación relacionadas. El desarrollo en el campo de la química de enaminas y la utilización de derivados imínicos de enolatos logró proporcionar una alternativa para las reacciones de alquilación de enolatos.
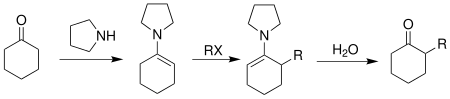
En 1963, G. Stork informó sobre la primera reacción de alquilación de enaminas para cetonas: la reacción de alquilación de enaminas de Stork . [10]
En 1976, Meyers informó sobre la primera reacción de alquilación de azaenolatos metalados de hidrazonas con un auxiliar a base de aminoácidos acíclicos. En comparación con los compuestos carbonílicos libres y las especies de enaminas quirales reportadas anteriormente, las hidrazonas exhiben mayor reactividad, regioselectividad y estereoselectividad . [11]
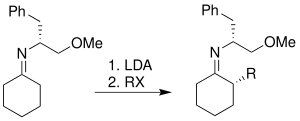
La combinación de derivados de aminoácidos cíclicos ( SAMP y RAMP ) y las potentes técnicas de hidrazona fueron iniciadas por EJ Corey y D. Enders en 1976, y posteriormente fueron desarrolladas de forma independiente por D. Enders. Tanto SAMP como RAMP se sintetizan a partir de aminoácidos. La síntesis detallada de estos dos auxiliares se muestra a continuación. [12] [13]

La alquilación de hidrazona Enders SAMP/RAMP comienza con la síntesis de la hidrazona a partir de una N,N-dialquilhidrazina y una cetona o aldehído [14].
Luego, la hidrazona se desprotona en la posición del carbono α mediante una base fuerte, como la diisopropilamida de litio (LDA), lo que lleva a la formación de un anión estabilizado por resonancia : un azaenolato. Este anión es un muy buen nucleófilo y ataca fácilmente a los electrófilos , como los haluros de alquilo, para generar hidrazonas alquiladas con la creación simultánea de un nuevo centro quiral en el carbono α.
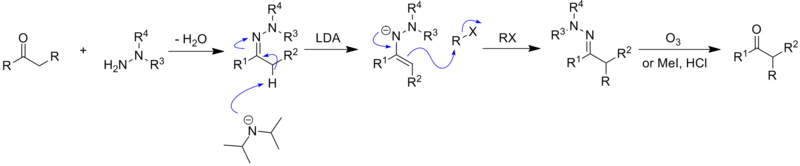
La estereoquímica de esta reacción se analiza en detalle en la siguiente sección.
Después de la desprotonación, la hidrazona se convierte en un azaenolato con catión de litio que quela tanto el nitrógeno como el oxígeno. Hay dos opciones posibles para la quelación del litio. Una es que el litio es antiperiplanar con respecto al enlace C=C (de color azul), lo que lleva a la conformación de Z C-N ; la otra es que el litio y el enlace C=C están en el mismo lado del enlace CN (de color rojo), lo que conduce al confórmero E C-N . También hay dos orientaciones disponibles para el nitrógeno quelante y el grupo R2 , siendo EC =C o ZC =C . Esto conduce a cuatro posibles intermedios de azaenolato ( A , B , C y D ) para la reacción de alquilación de hidrazona SAMP/RAMP de Enders.
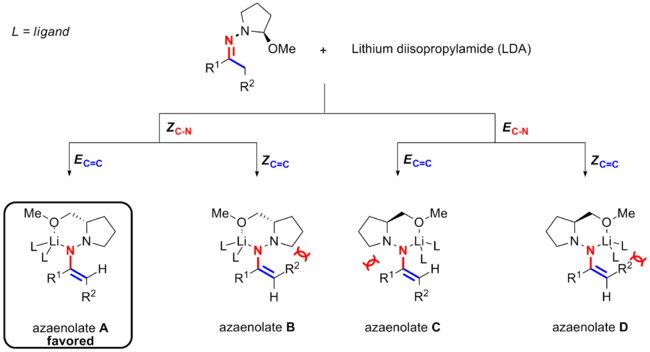
Experimentos y cálculos [2] [15] [16] muestran que un estereoisómero específico del azaenolato se ve favorecido sobre los otros tres posibles candidatos. Por lo tanto, aunque son posibles cuatro isómeros para el azaenolato, sólo uno (azaenolato A ) con la estereoquímica de sus dobles enlaces C=C siendo E y la de su enlace CN siendo la estereoquímica Z es dominante (E C=C Z C-N ) para cetonas tanto cíclicas como acíclicas. [17]
El azaenolato preferido es la molécula inicial dominante para la posterior reacción de alquilación. Hay dos posibles caras de acceso para que cualquier electrófilo reaccione. La interacción estérica entre el anillo de pirrolidina y el reactivo electrófilo dificulta el ataque del electrófilo desde la cara superior. Por el contrario, cuando el electrófilo ataca desde la cara inferior, no existe tal interacción desfavorable. Por tanto, el ataque electrófilo procede de la cara estéricamente más accesible. [18]

La quelación del catión litio con el grupo metoxi es una de las características más importantes del estado de transición de la reacción de alquilación de hidrazona de Enders. Es necesario tener este efecto de quelación para lograr una alta estereoselectividad . El desarrollo y modificación de la reacción de alquilación de hidrazona de Enders se centra principalmente en la adición de más impedimento estérico en los anillos de pirrolidina tanto de SAMP como de RAMP, preservando al mismo tiempo el grupo metoxi para la quelación del litio .
Las cuatro variantes más famosas de SAMP y RAMP son SADP, SAEP, SAPP y RAMBO, [19] [20] cuyas estructuras se muestran a continuación.

En 2011, se sintetizaron y estudiaron varios carbamatos N-amino cíclicos para detectar reacciones asimétricas de alquilación de hidrazona. [21] Tanto la estereoquímica como la regioselectividad de las reacciones resultaron ser muy prometedoras. Estos nuevos compuestos consisten en una nueva clase de auxiliares quirales basados en la estructura carbamato y, por tanto, ya no pertenecen a la familia de SAMP y RAMP. Pero sí proporcionan alternativas muy poderosas a los sistemas tradicionales de pirrolidina.

Las hidrazonas suelen ser muy estables frente a la solvólisis y la conversión a cetona puede requerir condiciones vigorosas. Además, las hidrazonas aldehídicas suelen ser desproporcionadas con respecto al nitrilo y la amina . [22]
Son comunes dos entornos de procesamiento principales : oxidación y solvólisis. Las conversiones reductivas son posibles con metales de transición de baja valencia , pero en 2000 seguían siendo relativamente poco estudiadas . [22][actualizar]
La escisión oxidativa tiene altos rendimientos y se utiliza con mayor frecuencia. El ozono o el oxígeno singlete pueden ozonolizar el enlace diazeno (y cualquier resto olefínico presente), dejando un carbonilo, una nitrosamina y dioxígeno . La oxidación más suave de Lemieux tolera acetales y éteres bencílicos . Los reactivos de peróxido (por ejemplo, NaBO 3 , (tBu4NSO4)2 o m -ClBzO 2 H ) escinden la hidrazona con velocidades, selectividades y mecanismos variables, pero la oxidación de Baeyer-Villiger es una reacción secundaria común. Los oxihaluros de metales de transición de alta valencia (por ejemplo, WF6 , CoF3 , MoOCl3 ) parecen escindirse principalmente a través de radicales. Todos, excepto el ozono y el oxígeno singlete, generan nitrilos a partir de hidrazonas aldehídicas, ya sea como producto principal o como producto secundario sustancial. [22]
Ciertos electrófilos también provocan nitrilos: cloroformiatos , alquinos fuertemente activados o yoduro de metilo y una base impedida . El yoduro de metilo también es útil para la hidrólisis: el yoduro de hidrazonio alquilado se hidroliza fácilmente a carbonilo e hidrazoformo, y el aire escinde el hidrazoformo a hidracina y dióxido de carbono . [22]
De hecho, una amplia variedad de ácidos promueven la hidrólisis. El tricloruro de bismuto escinde hidrazonas arbitrarias en un microondas . El ácido oxálico extrae hidracina de las hidrazonas cetónicas ; el aducto de oxalato luego se descompone en el auxiliar original en una base acuosa. El gel de sílice hidroliza sustratos exquisitamente sensibles a los ácidos, pero es demasiado débil para afectar las hidrazonas cetónicas adyacentes a un carbono primario . Las hidrazonas cetónicas adyacentes a un carbono secundario o terciario se hidrolizan en presencia de sales cúpricas catalíticas ; ese procedimiento también preserva los sustratos alterados por oxidantes o ácidos fuertes. [22]
El eterato de trifluoruro de boro cataliza la tiocetalización y la levadura de panadería hidroliza sustratos no bioactivos . [22]
Los carbamatos de hidrazona se escinden mucho más fácilmente que sus hidrazonas originales: el ácido para-toluenosulfónico produce las cetonas correspondientes en rendimientos casi cuantitativos. [21]

La reacción de alquilación de hidrazona de Ender suele realizarse mediante una secuencia de tres pasos. [14] El primer paso siempre debe ser la síntesis de las hidrazonas. La cetona o el aldehído se mezcla con SAMP o RAMP y se deja reaccionar en atmósfera de argón durante 12 horas. La hidrazona bruta obtenida se purifica por destilación o recristalización . A 0 grados centígrados , la hidrazona se transfiere a la solución etérea de diisopropilamida de litio. Luego esta mezcla se enfría a -110 grados centígrados y se añade lentamente el haluro de alquilo. Luego se deja que esta mezcla se caliente hasta temperatura ambiente. Después de 12 horas de reacción a temperatura ambiente, se deja que la hidrazona alquilada cruda reaccione con ozono en un tubo Schlenk para escindir el enlace C=N. Después de la destilación o cromatografía en columna , se puede obtener el producto de alquilación puro.
KC Nicolaou y sus compañeros de trabajo del Scripps Research Institute generaron la hidrazona quiral mediante la reacción de alquilación de hidrazona de Enders con alta estereoselectividad ( de > 95%). La posterior ozonólisis y la reacción de Wittig dieron lugar al fragmento de la cadena lateral del ácido zaragozico A, que es un potente medicamento para las enfermedades coronarias. [6]

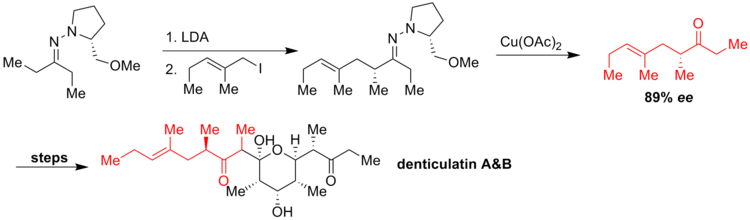
Ziegler y sus compañeros de trabajo hicieron reaccionar un yoduro de alilo con el azaenolato para generar una cadena de hidrocarburos quiral. Para evitar la pérdida de la pureza enantiomérica del producto, los autores utilizaron acetato cúprico para regenerar el grupo carbonilo, obteniendo sólo un rendimiento moderado para la escisión del enlace C=N pero una buena enantioselectividad ( ee = 89%). La cetona se transformó después de varios pasos en metabolitos de denticulatina A y polipropionato B aislados de Siphonaria Denticulata . [5]
(-)-C 10 -desmetil arteannuin B es un análogo estructural de la artemisinina antipalúdica . Exhibe una potente actividad antipalúdica incluso contra una cepa resistente a los medicamentos. Little y compañeros de trabajo obtuvieron la hidrazona alquilada en forma diastereoisómeramente pura ( de > 95%) mediante la reacción de alquilación de Enders. Este intermedio luego se elaboró en (-)-C 10 -desmetil arteannuin B. [4]

Se informa que la epotilona A y B son fármacos anticancerígenos muy eficaces. Varios de sus derivados estructurales muestran una inhibición muy prometedora contra el cáncer de mama con sólo efectos secundarios leves y algunos de ellos se encuentran ahora en fase de ensayo. En 1997, KC Nicolaou y sus compañeros de trabajo informaron sobre la primera síntesis total de epotilona A y B. La reacción de alquilación de Ender se utilizó al comienzo de la síntesis para instalar el centro estereogénico en C8. La reacción transcurrió con alto rendimiento y alta diastereoselectividad. [7]

{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ) Mantenimiento CS1: nombres numéricos: lista de autores ( enlace )[ enlace muerto permanente ]{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )