La aminación reductora (también conocida como alquilación reductora ) es una forma de aminación que implica la conversión de un grupo carbonilo en una amina a través de una imina intermedia . El grupo carbonilo es más comúnmente una cetona o un aldehído . Es un método común para producir aminas y se usa ampliamente en química verde, ya que se puede realizar catalíticamente en un solo recipiente en condiciones suaves. En bioquímica, las enzimas deshidrogenasas utilizan aminación reductora para producir el aminoácido glutamato. Además, se están realizando investigaciones sobre mecanismos de síntesis alternativos con varios catalizadores metálicos que permiten que la reacción requiera menos energía y requiera condiciones de reacción más suaves. La investigación de biocatalizadores, como las imino reductasas , ha permitido una mayor selectividad en la reducción de aminas quirales, que es un factor importante en la síntesis farmacéutica. [1]

La aminación reductora ocurre entre un carbonilo como un aldehído o cetona y una amina en presencia de un agente reductor . [2] Las condiciones de reacción son neutras o débilmente ácidas. [2]

La amina reacciona primero con el grupo carbonilo para formar una especie hemiaminal que posteriormente pierde una molécula de agua de manera reversible mediante sustitución alquilimino-desoxo-bi para formar el intermedio imina. [3] El equilibrio entre aldehído/cetona e imina se desplaza hacia la formación de imina por deshidratación. [2] Esta imina intermedia luego se puede aislar y reducir con un agente reductor adecuado (por ejemplo, borohidruro de sodio ) para producir el producto de amina final. [2] También puede ocurrir aminación reductora intramolecular para producir un producto de amina cíclica si la amina y el carbonilo están en la misma molécula del material de partida. [4]
Hay dos formas de realizar una reacción de aminación reductora: directa e indirecta. [2]
En una reacción directa, los materiales de partida carbonilo y amina y el agente reductor se combinan y las reducciones se realizan secuencialmente. [2] Estas son a menudo reacciones de un solo recipiente, ya que la imina intermedia no se aísla antes de la reducción final al producto. [2] En cambio, a medida que avanza la reacción, la imina se ve favorecida para la reducción sobre el material de partida carbonilo. [2] Los dos métodos más comunes para la aminación reductora directa son la hidrogenación con catalizadores catalíticos de platino, paladio o níquel y el uso de agentes reductores de hidruro como el cianoborohidruro (NaBH 3 CN). [2]
La aminación reductora indirecta, también llamada reducción gradual, aísla el intermediario imina. [2] En un paso separado, el intermedio de imina aislado se reduce para formar el producto de amina. [2]
Hay muchas consideraciones que hacer al diseñar una reacción de aminación reductiva. [5]
Para resolver el último problema, se pueden utilizar reacciones de aminación reductiva asimétrica para sintetizar un producto enantiopuro de aminas quirales. [5] En la aminación reductiva asimétrica, se utiliza un carbonilo que se puede convertir de aquiral a quiral. [6] El carbonilo se condensa con una amina en presencia de H 2 y un catalizador quiral para formar el intermedio imina, que luego se reduce para formar la amina. [6] Sin embargo, este método todavía es limitante para sintetizar aminas primarias que no son selectivas y propensas a la sobrealquilación. [6]
NaBH 4 reduce tanto las iminas como los grupos carbonilo. [3] Sin embargo, no es muy selectivo y puede reducir otros grupos funcionales reducibles presentes en la reacción. [3] Para garantizar que esto no ocurra, no se deben utilizar reactivos con grupos carbonilo electrófilos débiles, aminas nucleófilas pobres y centros reactivos estéricamente impedidos, ya que estas propiedades no favorecen la reducción del carbonilo para formar una imina y aumentan las posibilidades. que en su lugar se reducirán otros grupos funcionales. [3]
El cianoborohidruro de sodio es soluble en disolventes hidróxidos, estable en soluciones ácidas y tiene diferentes selectividades según el pH. [2] A valores de pH bajos, reduce eficientemente los aldehídos y las cetonas. [7] A medida que aumenta el pH, la velocidad de reducción se ralentiza y, en cambio, el intermediario imina se vuelve preferencial para la reducción. [7] Por esta razón, NaBH 3 CN es un agente reductor ideal para reacciones de aminación reductora directa en un solo recipiente que no aíslan la imina intermedia. [2]
Cuando se utiliza como agente reductor, NaBH 3 CN puede liberar subproductos tóxicos como HCN y NaCN durante el procesamiento. [2]
Esta reacción está relacionada con la reacción de Eschweiler-Clarke , en la que las aminas se metilan a aminas terciarias, la reacción de Leuckart-Wallach , [8] o mediante otros métodos de alquilación de aminas como la reacción de Mannich y la reacción de Petasis .
Una reacción clásica con nombre es la reacción de Mignonac (1921) [9] que implica la reacción de una cetona con amoníaco sobre un catalizador de níquel, por ejemplo, en una síntesis de 1-feniletilamina a partir de acetofenona : [10]
Además, existen muchos sistemas que catalizan la aminación reductora con un catalizador de hidrogenación . [11] Generalmente, se prefiere la catálisis a las reacciones estequiométricas para permitir que la reacción sea más eficiente, más económica en átomos y produzca menos desechos. [12] Puede ser un sistema catalítico homogéneo o un sistema heterogéneo. [11] Estos sistemas proporcionan un método alternativo que es eficiente, requiere menos reactivos volátiles y es económico redox. [11] [13] Además, este método se puede utilizar en la reducción de alcoholes , junto con aldehídos y cetonas para formar el producto amina . [11] Un ejemplo de un sistema catalítico heterogéneo es la aminación reductora de alcoholes utilizando el sistema catalizado con Ni. [11] [14]

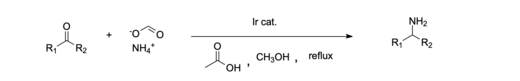
El níquel se utiliza comúnmente como catalizador para la aminación reductiva debido a su abundancia y actividad catalítica relativamente buena. [11] [15] Un ejemplo de un sistema catalítico homogéneo es la aminación reductora de cetonas realizada con un catalizador de iridio . [16] Además, se ha demostrado que es eficaz utilizar un sistema catalítico de iridio (III) homogéneo para aminar reductivamente ácidos carboxílicos , lo que en el pasado ha sido más difícil que los aldehídos y las cetonas. [12] Los catalizadores homogéneos a menudo se prefieren porque son más respetuosos con el medio ambiente y económicamente en comparación con la mayoría de los sistemas heterogéneos. [11]
En la industria, las aminas terciarias como la trietilamina y la diisopropiletilamina se forman directamente a partir de cetonas con una mezcla gaseosa de amoniaco e hidrógeno y un catalizador adecuado.
La aminación reductiva se usa comúnmente sobre otros métodos para introducir aminas en sustratos alquílicos, como reacciones de tipo SN 2 con haluros , ya que se puede realizar en condiciones suaves y tiene una alta selectividad para compuestos que contienen nitrógeno. [17] [18] La aminación reductora puede ocurrir secuencialmente en reacciones de un solo recipiente, lo que elimina la necesidad de purificaciones intermedias y reduce el desperdicio. [17] Algunas vías sintéticas de varios pasos se han reducido a un solo paso mediante aminación reductiva en un solo recipiente. [17] Esto lo convierte en un método muy atractivo para producir aminas en la química verde.
En bioquímica, las enzimas deshidrogenasas pueden catalizar la aminación reductora de α-cetoácidos y amoníaco para producir α- aminoácidos . La aminación reductora se utiliza predominantemente para la síntesis del aminoácido glutamato a partir del α-cetoglutarato, mientras que la bioquímica se basa en gran medida en la transaminación para introducir nitrógeno en los otros aminoácidos. [19] El uso de enzimas como catalizador es ventajoso porque los sitios activos de las enzimas a menudo son estereoespecíficos y tienen la capacidad de sintetizar selectivamente un determinado enantiómero . [20] Esto es útil en la industria farmacéutica, particularmente para el desarrollo de fármacos , porque los pares de enantiómeros pueden tener diferentes reactividades en el cuerpo. [1] [21] Además, los biocatalizadores enzimáticos suelen ser bastante selectivos en cuanto a reactividad, por lo que pueden usarse en presencia de otros grupos funcionales, sin el uso de grupos protectores . [20] [22] Por ejemplo, una clase de enzimas llamadas imino reductasas , IRED, se puede utilizar para catalizar la aminación reductora asimétrica directa para formar aminas quirales. [1] [22]
En el drama aclamado por la crítica Breaking Bad , el personaje principal Walter White utiliza la reacción de aminación reductiva para producir su metanfetamina de alta pureza , basándose en fenil-2-propanona y metilamina .