La química del organotecnecio es la ciencia que describe las propiedades físicas, la síntesis y las reacciones de los compuestos de organotecnecio , que son compuestos organometálicos que contienen enlaces químicos carbono - tecnecio . Los compuestos de organotecnecio más comunes son complejos de coordinación utilizados como agentes de formación de imágenes radiofarmacéuticos . [1] [2]
En general, los compuestos de organotecnecio no se suelen utilizar en reacciones químicas o catálisis debido a su radiactividad . La investigación sobre la química del tecnecio a menudo se realiza junto con el renio como alternativa isoelectrónica no radiactiva al tecnecio. [3]
El tecnecio se utilizó por primera vez como radiofármaco en 1961. [4] De los radiofármacos de uso clínico para SPECT (tomografía computarizada por emisión de fotón único), la mayoría de los compuestos son complejos de 99m Tc . [5] Actualmente existen y se utilizan tres generaciones de radiofármacos de tecnecio. La primera generación no se localiza específicamente y se consideran agentes de perfusión. La segunda generación tiene una porción de direccionamiento basada en péptidos . La tercera generación de radiofármacos de tecnecio presenta compuestos organotecnecio que pueden localizarse en el cuerpo de forma biomimética . [6] [7] [8]
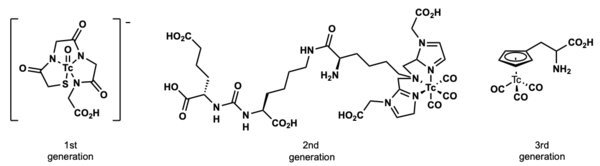
Una gran mayoría de los compuestos de tecnecio utilizados en el diagnóstico y la obtención de imágenes radiofarmacéuticas son complejos de coordinación inorgánicos . Hay una serie de compuestos organometálicos de organotecnecio "clásicos", que contienen específicamente enlaces carbono-tecnecio y que se encuentran en uso clínico. Estos compuestos de organotecnecio se ven principalmente como compuestos de tecnecio tricarbonilo y compuestos de tecnecio ciclopentadienilo .

Uno de los compuestos radiofarmacéuticos más destacados en uso clínico es Cardiolie® , también conocido como 99m Tc- Sestamibi . Este compuesto de organotecnecio se aplica para la obtención de imágenes del miocardio . La configuración electrónica d 6 es muy estable debido a su bajo estado de oxidación . [9] El complejo Tc(I) se estabiliza aún más gracias al alto potencial reductor de los ligandos de isonitrilo . [10]
El complejo de organotecnecio piano-taburete mencionado anteriormente es un radiofármaco de tercera generación. El ligando ciclopentadienilo actúa como bioisostero de un grupo fenilo en el aminoácido fenilalanina . [11]
El 99m Tc radiactivo se obtiene en forma de pertecnetato en solución acuosa diluida a partir de generadores de 99 Mo/ 99m Tc. Luego, el pertecnetato se puede convertir en precursores de carbonilo e hidrato más útiles para la posterior síntesis en complejos de tecnetato.
Como los radiometales de partida están más disponibles en solución acuosa debido al método de aislamiento, la química para la síntesis de compuestos de tecnetato debe realizarse en solución acuosa.
El estudio de los compuestos de tecnecio normalmente se realiza en combinación con renio como una alternativa isoelectrónica y no radiactiva al tecnecio.
Para 99m Tc y 188 Re, la síntesis de compuestos comienza con pertecnetato o perrenato en solución salina a baja concentración, obtenido a partir de generadores de 99 Mo/ 99m Tc y 188 W/ 188 Re. Los precursores de aquotricarbonilo son útiles para acceder a los complejos de Tc y Re. Los metales tienen una configuración electrónica d 6 de bajo espín, lo que proporciona una alta estabilidad cinética y enlaces MC altamente estables. En consecuencia, los tres ligandos de CO siempre permanecen coordinados, mientras que los ligandos reemplazan fácilmente a las tres moléculas de agua. Por tanto, los compuestos típicos de organotecnecio presentan el motivo tricarbonilo.

Los métodos típicos de síntesis de compuestos organometálicos son difíciles de utilizar. Para que sea útil como radiofármaco, la reacción debe realizarse en una solución salina acuosa que pueda inyectarse en el cuerpo por vía intravenosa.
Martin Wenzel desarrolló una reacción de transferencia de doble ligando (DLT) para la síntesis de complejos de organotecnecio/organorrenio. [12] La reacción presenta la síntesis de compuestos organotecnecio-taburete de piano a partir de ferroceno . La reacción fue estudiada y optimizada más a fondo por Katzenellegbogen . [13] Desafortunadamente, la utilidad de este método en la síntesis de radiofármacos está limitada por el uso de disolventes orgánicos .

Se propone que este mecanismo proceda por deslizamiento del anillo. Primero, reducción y carbonilación del pertecnetato/perrenato con CrCl 3 y/o Cr(CO) 6 desde el intermedio de 6 coordenadas. La reacción posterior con el ferroceno sustituido a través de intermedios puenteados y con anillo deslizante da el producto. La transferencia del anillo más deficiente en electrones se ve favorecida por la estabilización del estado de transición del deslizamiento del anillo η 5 - η 3 del ferroceno.

La síntesis acuosa permite el desarrollo de radiofármacos médicamente relevantes. La primera síntesis acuosa de fac -[ 99m Tc(η 5 -Cp-C(O)CH 3 )(CO) 3 ] fue descrita por el laboratorio de Alberto que utilizó un retro Diels-Alder mediado por metal para sintetizar los complejos de organotecnecio. [14]
De manera gradual, el carboxilato primero se coordina con el tecnecio, seguido de la coordinación con el ciclopentadieno adyacente (Ruta A). La reacción es termodinámicamente impulsada, dada una fuerte interacción electrónica entre [ 99m Tc(CO) 3 ] + y el ciclopentadieno .

La formación favorable del {(η 5 -Cp)Tc} como fuerza impulsora para la formación del producto 2, impulsó el uso del dímero de Diels-Ader (HCp-COOH) 2 (ácido de Thiele) como precursor del ciclopentadieno. . El craqueo térmico de 3 normalmente requiere T >160 °C. La reacción de 3 y 1 a 95 °C durante 30 min en tampón dio la formación cuantitativa de 2. Como no se observó HCp-COOH libre, se excluyó el retro Diels-Alder in situ y la entrada posterior en la ruta A.
La reacción retro de Diels-Alder mediada por metal sugiere un enfoque general para [(Cp-R) 99m Tc(CO) 3 ], permitiendo el acceso a una variedad de grupos R en el anillo Cp.

Con el desarrollo de este método retro Diels-Alder para la síntesis de complejos de 99m Tc y Re en medios acuosos por parte del laboratorio Alberto, ahora es posible el etiquetado de biomoléculas con complejos tipo taburete de piano. Permitir el acceso al desarrollo de nuevos radiofármacos.
Se ha demostrado que el tecnecio reacciona de manera similar al osmio . Capaz de catalizar una dihidroxilación cis .
