
El punto de control de daño del ADN G 2 -M es un importante punto de control del ciclo celular en organismos eucariotas que garantiza que las células no inicien la mitosis hasta que el ADN dañado o replicado de forma incompleta se haya reparado lo suficiente. Las células con un punto de control G 2 -M defectuoso sufrirán apoptosis o muerte después de la división celular si entran en la fase M antes de reparar su ADN. [1] La característica bioquímica definitoria de este punto de control es la activación de los complejos ciclina-CDK de la fase M , que fosforilan proteínas que promueven el ensamblaje del huso y llevan a la célula a la metafase . [2]
El ciclo celular está impulsado por proteínas llamadas quinasas dependientes de ciclina que se asocian con proteínas reguladoras de ciclina en diferentes puntos de control del ciclo celular. En diferentes fases del ciclo celular se activan o desactivan complejos ciclina-CDK específicos.
La actividad de CyclinB-CDK1 es específica del punto de control G2/M. La acumulación de ciclina B aumenta la actividad de la quinasa dependiente de ciclina Cdk1, homóloga humana Cdc2, a medida que las células se preparan para entrar en mitosis. La actividad de Cdc2 se regula además mediante la fosforilación / desfosforilación de sus activadores e inhibidores correspondientes. A través de un ciclo de retroalimentación positiva , CyclinB-Cdc2 activa la fosfatasa Cdc25 , que a su vez desactiva los inhibidores de CyclinB-Cdc2, Wee1 y Myt1. Cdc25 activa el complejo mediante la eliminación de fosfatos del sitio activo, mientras que Wee1 inactiva el complejo mediante la fosforilación de residuos de tirosina, específicamente tirosina-15. [3]
Este bucle se amplifica aún más indirectamente a través de la interacción coordinada de la quinasa Aurora A y el cofactor Bora. Durante la fase G2 , Bora se acumula y forma un complejo de activación con Aurora A. Este complejo luego regula la activación de la quinasa tipo Polo 1 (Plk1). Plk1 fosforila Wee1, dirigiéndolo para su degradación a través del complejo de ubiquitina ligasa SCF ( complejo SCF ), y activa Cdc25 a través de la fosforilación con acción combinada activando Cdc2. La actividad combinada y el complejo de Cdc2, Cdc25 y Plk1 con la acumulación de ciclina B activa el complejo CyclinB-Cdc2, promoviendo la entrada en mitosis. [4]
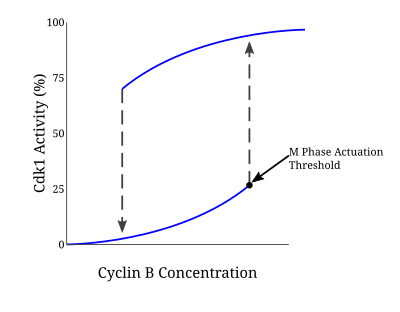
Muchas proteínas involucradas en este ciclo de retroalimentación positiva impulsan la activación del complejo CyclinB-Cdc2 porque la entrada en la mitosis requiere una respuesta de todo o nada. El modelo de Novak-Tyson es un modelo matemático utilizado para explicar este ciclo regulador que predijo la transición irreversible a la mitosis impulsada por la histéresis. [5] A través de experimentos en extractos de óvulos libres de células de Xenopus laevis , se confirmó que este modelo es la base para la entrada en la mitosis. Una vez que la concentración de ciclina alcanza un cierto umbral mínimo de activación, Cdc2 se activa rápidamente. Permanece en este estado hasta que la actividad cae por debajo de un umbral de inactivación separado en el que se inactiva abruptamente a través de la fosforilación de tirosina por Wee1 y Myt1. En el caso del ADN no replicado, el umbral de concentración de ciclina para la activación de Cdc2 aumenta aún más. A través de este mecanismo, existen dos condiciones de estado estable separadas por un estado estable inestable. La naturaleza biestable e histerética de CyclinB-Cdc2 asegura una naturaleza altamente regulada del punto de control G2/M. [6]
Las proteínas que se localizan en los sitios de daño del ADN en la fase G2 inician una cascada de señalización que regula componentes importantes de la vía, como se describió anteriormente, controlando así la entrada mitótica a través de la actividad de CyclinB-Cdc2. La regulación negativa de la actividad de CyclinB-Cdc2 da como resultado un retraso en la entrada mitótica, lo cual es importante para que las células reparen cualquier daño del ADN que pueda haberse acumulado después de la fase S y es necesario antes de que la división celular pueda continuar.
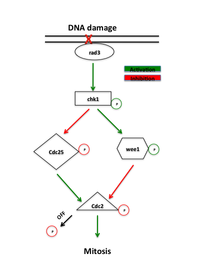
Las proteínas que funcionan en el punto de control G2-M se identificaron originalmente en pruebas de levadura que buscaban mutantes que mostraran una mayor sensibilidad a la radiación, denominados mutantes "rad". [1] La reparación ineficiente del ADN dañado por la radiación ionizante o los agentes químicos en estos mutantes reveló proteínas esenciales en esta vía. Las proteínas de señalización temprana en la vía del punto de control son miembros de una familia de fosfatidilinositol 3-quinasas, rad3 en levadura y ATR en vertebrados, que se cree que se localizan en sitios de daño del ADN. [7] Rad3 fosforila rad26, que es necesario para iniciar, pero no para mantener el punto de control. Rad3 también fosforila una serie de otras proteínas cuya ausencia anula la reparación del ADN del punto de control, incluidas rad1, rad9, hus1 y rad17. [1] Se ha planteado la hipótesis de que rad9, hus1 y rad17 son similares a las proteínas implicadas en la formación de la abrazadera que aumenta la procesividad de la ADN polimerasa durante la replicación del ADN . [8] De acuerdo con esta idea, rad17 es similar a las proteínas involucradas en la carga de la pinza en el ADN. Esto respalda un modelo donde la fosforilación por rad3 causa el reclutamiento de estas proteínas a sitios de daño del ADN donde median la actividad de las ADN polimerasas involucradas en la reparación del ADN . [1]
El principal efector de rad3 es la quinasa Chk1 , que es necesaria para el arresto G2-M en respuesta a agentes que dañan el ADN. [9] Chk1 es una proteína quinasa efectora que mantiene la ciclina mitótica en un estado inactivo y es fosforilada por rad3 entre la fase S y la mitosis, lo que implica su papel específico en el arresto G2. [10] Su regulación positiva a través de la sobreexpresión puede inducir el arresto independientemente del daño al ADN. [11] Además, la sobreexpresión de Chk1 rescata la sensibilidad a la radiación de los mutantes rad, presumiblemente al permitir que la reparación del ADN tenga lugar antes de la entrada en la mitosis. [7]
La presencia de daño en el ADN desencadena las vías ATM (Ataxia telangiectasia mutada) o ATR (Ataxia telangiectasia y relacionada con Rad3) que activan las quinasas Chk2 y Chk1, respectivamente. Estas quinasas actúan aguas arriba de Cdc25 y Wee1, los reguladores directos del complejo CyclinB-Cdc2. Chk1 y Chk2 fosforilan Cdc25, inhibiendo su actividad fosforilante y marcándolo para la degradación ubiquitinada. [11] [12] Estas vías también estimulan el supresor tumoral p53 . p53 regula la función del inhibidor de Cdk2 p21 y las proteínas 14-3-3 que fosforilan (y por lo tanto inactivan) y secuestran Cdc25 en el citoplasma, respectivamente. [13] Estudios recientes también han sugerido que Cdk1 y 14-3-3 regulan positivamente Wee1 de manera similar. La hiperfosforilación de Wee1 por Cdk1 permite la unión de 14-3-3, secuestrando Wee1 al núcleo y mejorando su capacidad para fosforilar Cdc2. [14] La fosforilación tanto de Wee1 como de Cdc25 previene la activación de Cdc2. [12]
La vía ATM/ATR también produce una regulación negativa de Plk1 que contribuye a la estabilidad de Wee1. La estabilización de Wee1 y Myt1 garantiza el arresto de las células en G2 y permite la reparación del ADN. [13] [15]
En la respuesta del punto de control intervienen múltiples vías y, por tanto, la focalización de Cdc25 no es el único mecanismo subyacente al retraso del ciclo celular, como han propuesto algunos modelos. La cooperatividad entre la regulación positiva de Wee1 y la regulación negativa de Cdc25 por Chk1 en respuesta al ADN no replicado o dañado da como resultado un fuerte arresto G2. [1] [11] [13] [15] El aumento de la cantidad de Wee1 y la disminución de la cantidad de Cdc25 contribuyen al aumento del umbral de concentración de ciclina B en el bucle de histéresis necesario para llevar a la célula a la mitosis.
Rad3 es necesario para la activación de Chk1 y el inicio del arresto G2, pero se cree que diferentes proteínas mantienen el arresto G2 para que pueda ocurrir una reparación suficiente del ADN. Una de estas proteínas es rad18 , que es necesaria para el arresto G2 incluso cuando Chk1 está fosforilada y activa. Por lo tanto, rad18 es necesario para el mantenimiento del punto de control G2/M, mientras que Chk1 es necesaria para el inicio del punto de control. [16] Esto se ve respaldado además por su función adicional en la reparación del ADN, específicamente en el mantenimiento de las estructuras cromosómicas. Su necesidad se demuestra por el hecho de que en ausencia de rad18, el ADN no puede repararse incluso cuando el arresto G2 se prolonga por otros medios.
El mantenimiento de dicha detención en la fase G2 se mantiene además mediante p53 y p21. En ausencia de p53 o p21, se demostró que las células irradiadas progresaban hacia la mitosis. [17] La ausencia de p21 o 14-3-3 no puede inhibir suficientemente el complejo CyclinB-Cdc2, exhibiendo así el control regulador de p53 y p21 en el punto de control G2 en respuesta al daño del ADN. [12] Las mutaciones de p53 pueden resultar en un déficit significativo del punto de control, lo que tiene implicaciones importantes en el tratamiento del cáncer.
La inactivación de Wee1 y Cdc25 elimina el punto de control de daño del ADN G2-M. La ausencia de Wee1 o la eliminación del sitio de tirosina-15 elimina la regulación negativa de la actividad de Cdc2 y hace que las células entren en mitosis sin completar la reparación, lo que elimina efectivamente el punto de control G2-M. [18] La ausencia de Cdc25 detiene a las células en G2, pero aún permite la activación del punto de control G2-M, lo que implica que tanto la activación de Wee1 como la desactivación de Cdc25 son pasos reguladores importantes en el punto de control. [11]
La inactivación de Chk1 es suficiente para superar el punto de control y promover la entrada en la mitosis, independientemente de si se repara el daño del ADN. Sin embargo, todavía se sabe poco sobre el mecanismo exacto de la terminación del punto de control; entre los posibles mecanismos se incluyen las fosfatasas proteicas que revierten las fosforilaciones activadoras, la degradación dirigida por ubiquitina de las proteínas activadoras y los antagonistas del punto de control que promueven la mitosis a través de vías independientes. [10]
Se ha descubierto que muchos reguladores del ciclo celular, como las Cdks, las ciclinas y el p53, tienen una expresión anormal en el cáncer. Más específicamente, se los ha implicado en la transición G2/M al localizarse en el centrosoma, lo que conduce a estudios para manipular dichas proteínas con el fin de mejorar la sensibilidad del cáncer a la radiación y la quimioterapia. [13] Chk1 tiene implicaciones importantes en la selección de fármacos para el cáncer, ya que su función actúa en respuesta al daño del ADN. Actualmente se están estudiando los efectos citotóxicos de la quimioterapia en la modulación de la transición G2/M, tanto en relación con la anulación del punto de control como con su detención. [19] Muchas terapias se centran en la inactivación del punto de control para obligar a las células con un daño excesivo del ADN a pasar por la mitosis e inducir la muerte celular. [12]