Los iones polihalógenos son un grupo de cationes y aniones poliatómicos que contienen únicamente halógenos . Los iones se pueden clasificar en dos clases: iones isopolihalógenos que contienen solo un tipo de halógeno e iones heteropolihalógenos con más de un tipo de halógeno.
Se han encontrado numerosos iones polihalógenos, con sus sales aisladas en estado sólido y caracterizadas estructuralmente. Las siguientes tablas resumen las especies conocidas. [1] [2] [3] [4] [5] [6]
* [Cl 2 ] + sólo puede existir como [Cl 2 O 2 ] 2+ a bajas temperaturas, un complejo de transferencia de carga de O 2 a [Cl 2 ] + . [2] El [Cl 2 ] + libresólo se conoce por su espectro de banda electrónica obtenido en un tubo de descarga de baja presión. [3]
† La existencia de [I 7 ] + es posible pero aún incierta. [1]

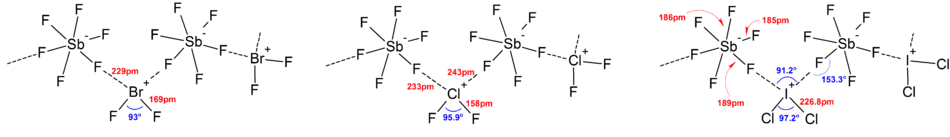

La mayoría de las estructuras de los iones se han determinado mediante espectroscopia IR , espectroscopia Raman y cristalografía de rayos X. Los iones polihalógenos siempre tienen el halógeno más pesado y menos electronegativo presente en el ion como átomo central, lo que hace que el ion sea asimétrico en algunos casos. Por ejemplo, [Cl 2 F] + tiene una estructura de [Cl−Cl−F] − pero no [Cl−F−Cl] − .
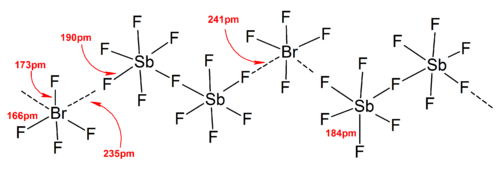
En general, las estructuras de la mayoría de los iones heteropolihalógenos y de los iones isopolihalógenos inferiores estaban de acuerdo con el modelo VSEPR . Sin embargo, hubo casos excepcionales. Por ejemplo, cuando el átomo central es pesado y tiene siete pares libres , como [BrF 6 ] − y [IF 6 ] − , tienen una disposición octaédrica regular de ligandos de fluoruro en lugar de una distorsionada debido a la presencia de un átomo estereoquímicamente. par solitario inerte . Se encontraron más desviaciones del modelo VSEPR ideal en las estructuras de estado sólido debido a fuertes interacciones catión-anión, lo que también complica la interpretación de los datos espectroscópicos vibratorios . En todas las estructuras conocidas de las sales de aniones polihalógenos, los aniones están en contacto muy estrecho, a través de puentes halógenos, con los contracationes. [4] Por ejemplo, en estado sólido, [IF 6 ] - no es regularmente octaédrico, ya que la estructura en estado sólido de [(CH 3 ) 4 N] + [IF 6 ] - revela [I 2 F 11 ] 2 débilmente unido. − dímeros. También se encontraron interacciones catión-anión significativas en [BrF 2 ] + [SbF 6 ] − , [ClF 2 ] + [SbF 6 ] − , [BrF 4 ] + [Sb 6 F 11 ] − . [2]
‡ [IF 5 ] 2− es una de las dos especies de tipo XY n que se sabe que tienen la rara geometría plana pentagonal, la otra es [XeF 5 ] − .
¶ [ClF 6 ] - es octaédrico distorsionado ya que el efecto estereoquímico del par inerte no es significativo en el átomo de cloro.
Los iones [I 3 Cl 2 ] + y [I 3 Br 2 ] + tienen una estructura de tipo trans - Z , análoga a la de [I 5 ] + .
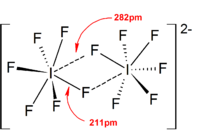
Los iones poliyoduro tienen estructuras mucho más complicadas. Los poliyoduros discretos generalmente tienen una secuencia lineal de átomos de yodo e iones yoduro, y se describen en términos de asociación entre unidades I 2 , I - y [I 3 ] - , lo que refleja el origen del poliyoduro. En estado sólido, los poliyoduros pueden interactuar entre sí para formar cadenas, anillos o incluso complicadas redes bidimensionales y tridimensionales.
Los enlaces en iones polihalógenos implican principalmente el uso predominante de orbitales p. Una participación significativa de los orbitales d en la unión es improbable, ya que se necesitará mucha energía promocional, mientras que en especies que contienen yodo se espera una participación escasa de los orbitales s debido al efecto del par inerte , como lo sugieren los datos de la espectroscopía de Mössbauer . Sin embargo, ningún modelo de unión ha sido capaz de reproducir una gama tan amplia de longitudes y ángulos de unión observados hasta ahora. [3]
Como se esperaba del hecho de que se elimina un electrón del orbital antienlazante cuando X 2 se ioniza a [X 2 ] + , el orden de enlace así como la fuerza del enlace en [X 2 ] + aumenta, en consecuencia las distancias interatómicas en el El ion molecular es menor que el de X 2 .
Los polihaluros triatómicos lineales o casi lineales tienen enlaces más débiles y más largos en comparación con los del interhalógeno o halógeno diatómico correspondiente, lo que coincide con la repulsión adicional entre átomos a medida que el ion haluro se agrega a la molécula neutra. Existe otro modelo que implica el uso de la teoría de la resonancia , por ejemplo, [ICl 2 ] - puede verse como el híbrido de resonancia de las siguientes formas canónicas :

La evidencia que respalda esta teoría proviene de las longitudes de los enlaces (255 pm en [ICl 2 ] - y 232 pm en ICl (g)) y los números de onda de estiramiento de los enlaces (267 y 222 cm -1 para estiramientos simétricos y asimétricos en [ICl 2 ] - comparados con 384 cm −1 en ICl), lo que sugiere un orden de enlace de aproximadamente 0,5 para cada enlace I-Cl en [ICl 2 ] − , consistente con la interpretación utilizando la teoría de la resonancia. Otras especies triatómicas [XY 2 ] − pueden interpretarse de manera similar. [2]
Aunque tienen un orden de enlace reducido, los tres átomos de halógeno están estrechamente unidos. El enlace flúor-flúor del trifluoruro, con orden de enlace 0,5, tiene una fuerza de enlace de 30 kcal/mol, sólo 8 kcal/mol menos que el enlace flúor-flúor en diflúor cuyo orden de enlace es 1. [7]
La formación de iones polihalógenos puede verse como la autodisociación de sus interhalógenos o halógenos originales :
Existen dos estrategias generales para preparar cationes polihalógenos:
En algunos casos, el propio ácido de Lewis (el aceptor de fluoruro ) actúa como oxidante:
Normalmente, el primer método se emplea para preparar cationes heteropolihalógenos y el segundo es aplicable a ambos. El proceso oxidativo es útil en la preparación de los cationes [IBr 2 ] + , [ClF 6 ] + , [BrF 6 ] + , ya que sus interhalógenos originales, IBr 3 , ClF 7 , BrF 7 respectivamente, nunca han sido aislados:
La preparación de algunas especies individuales se resume brevemente en la siguiente tabla con ecuaciones: [1] [2] [3] [4]
‡ En esta reacción, la especie oxidante activa es [NiF 3 ] + , que se forma in situ en el sistema Cs 2 [NiF 6 ] / AsF 5 /HF. Es un agente oxidante y fluorante aún más potente que el PtF 6 .
Para los aniones polihalógenos, también existen dos estrategias generales de preparación:
La preparación de algunas especies individuales se resume brevemente en la siguiente tabla con ecuaciones: [1] [2] [3] [4]
Los poliyoduros superiores se formaron tras la cristalización de soluciones que contenían diversas concentraciones de I − y I 2 . Por ejemplo, el monohidrato de K + [I 3 ] − cristaliza cuando se enfría una solución saturada que contiene cantidades apropiadas de I 2 y KI . [8] : v1p294
En general, un contracatión o anión grande (como Cs + y [SbF 6 ] − ) puede ayudar a estabilizar los iones polihalógenos formados en estado sólido a partir de consideraciones de energía reticular , a medida que aumenta la eficiencia del empaquetamiento.
Los cationes polihalógenos son agentes oxidantes fuertes, como lo indica el hecho de que sólo pueden prepararse en líquidos oxidantes como disolvente, como el óleum . Las más oxidantes y por tanto más inestables son las especies [X 2 ] + y [XF 6 ] + (X = Cl, Br), seguidas de [X 3 ] + y [IF 6 ] + .
La estabilidad de las sales [X 2 ] + (X = Br, I) es termodinámicamente bastante estable. Sin embargo, su estabilidad en solución depende del disolvente superácido . Por ejemplo, [I 2 ] + es estable en ácido fluoroantimónico (HF con 0,2 N SbF 5 , H = −20,65), pero es desproporcionado con [I 3 ] + , [I 5 ] + e I 2 cuando son aceptores de fluoruro más débiles, como NbF 5 , TaF 5 o NaF , se añaden en lugar de SbF 5 . [4]
Para los aniones polihalógenos con el mismo catión, los más estables son aquellos con un halógeno más pesado en el centro; los iones simétricos también son más estables que los asimétricos. por tanto la estabilidad de los aniones disminuye en el orden:
Los iones heteropolihalógenos con un número de coordinación mayor o igual a cuatro sólo pueden existir con ligandos de fluoruro.
La mayoría de los iones polihalógenos tienen colores intensos, y su color se intensifica a medida que aumenta el peso atómico del elemento constituyente. El conocido complejo almidón -yodo tiene un color azul intenso debido a los iones lineales [I 5 ] − presentes en la hélice de amilosa . [4] Algunos colores de las especies comunes se enumeran a continuación: [3]
Los cationes heteropolihalógenos son oxidantes explosivamente reactivos y los cationes a menudo tienen una reactividad mayor que sus interhalógenos originales y se descomponen por vías reductoras. Como se esperaba del estado de oxidación más alto de +7 en [ClF 6 ] + , [BrF 6 ] + y [IF 6 ] + , estas especies son agentes oxidantes extremadamente fuertes, como lo demuestran las reacciones que se muestran a continuación:
Los cationes polihalógenos con estados de oxidación más bajos tienden a desproporcionarse . Por ejemplo, [Cl 2 F] + es inestable en solución y desproporcionado completamente en la mezcla HF/ SbF 5 incluso a 197 K:
[I 2 ] + se dimeriza reversiblemente a 193 K, y se observa como el color azul del [I 2 ] + paramagnético cambia dramáticamente al color marrón rojizo del [I 2 ] + diamagnético , junto con una caída en la susceptibilidad paramagnética y eléctrica. Conductividad cuando la solución se enfría por debajo de 193 K: [2]
La dimerización se puede atribuir a la superposición de los orbitales π* medio llenos en dos [I 2 ] + .
[Cl 4 ] + en [Cl 4 ] + [IrF 6 ] − es estructuralmente análogo a [I 4 ] 2+ , pero se descompone a 195 K para dar Cl 2 , y sales de [Cl 3 ] + en lugar de [Cl 2 ] + . [2]
Los intentos de preparar ClF 7 y BrF 7 fluorando [ClF 6 ] + y [BrF 6 ] + usando NOF han fracasado porque se produjeron las siguientes reacciones: [3]
Los aniones son menos reactivos en comparación con los cationes y generalmente son oxidantes más débiles que sus interhalógenos originales. Son menos reactivos con los compuestos orgánicos y algunas sales tienen una estabilidad térmica bastante alta. Las sales que contienen aniones polihalógenos del tipo M + [X m Y n Z p ] − , donde m + n + p = {3, 5, 7, 9...}, tienden a disociarse en sales monohaluro simples entre M + y el halógeno más electronegativo , de modo que el monohaluro tiene la mayor energía reticular. Como otro producto normalmente se forma un interhalógeno. La sal [(CH 3 ) 4 N] + [ClF 4 ] − se descompone a aproximadamente 100 °C, y las sales de [ClF 6 ] − son térmicamente inestables y pueden explotar incluso a −31 °C. [4]