
En neurofisiología , una punta dendrítica se refiere a un potencial de acción generado en la dendrita de una neurona . Las dendritas son extensiones ramificadas de una neurona. Reciben señales eléctricas emitidas por las neuronas que se proyectan y transfieren estas señales al cuerpo celular o soma . La señalización dendrítica se ha visto tradicionalmente como un modo pasivo de señalización eléctrica. A diferencia de su homólogo axónico que puede generar señales a través de potenciales de acción, se creía que las dendritas sólo tenían la capacidad de propagar señales eléctricas por medios físicos: cambios en conductancia, longitud, área de sección transversal, etc. Sin embargo, se propuso la existencia de picos dendríticos y Lo demostraron W. Alden Spencer, Eric Kandel , Rodolfo Llinás y sus compañeros de trabajo en la década de 1960 [1] [2] y una gran cantidad de evidencia ahora deja claro que las dendritas son estructuras neuronales activas. Las dendritas contienen canales iónicos dependientes de voltaje que les dan la capacidad de generar potenciales de acción. Se han registrado picos dendríticos en numerosos tipos de neuronas del cerebro y se cree que tienen grandes implicaciones en la comunicación neuronal, la memoria y el aprendizaje . Son uno de los principales factores de potenciación a largo plazo .
Un pico dendrítico se inicia de la misma manera que un potencial de acción axonal. La despolarización de la membrana dendrítica provoca la apertura de canales iónicos dependientes de voltaje de sodio y potasio. La entrada de iones de sodio provoca un aumento de voltaje. Si el voltaje aumenta más allá de un cierto umbral, la corriente de sodio activa otros canales de sodio dependientes de voltaje que transmiten una corriente a lo largo de la dendrita. Los picos dendríticos se pueden generar a través de canales dependientes de voltaje de sodio y calcio. Los picos dendríticos suelen transmitir señales a un ritmo mucho más lento que los potenciales de acción axonales. [3] Los umbrales de voltaje local para la iniciación de picos dendríticos suelen ser más altos que los de la iniciación del potencial de acción en el axón; por lo tanto, el inicio del pico generalmente requiere una entrada fuerte. [4]
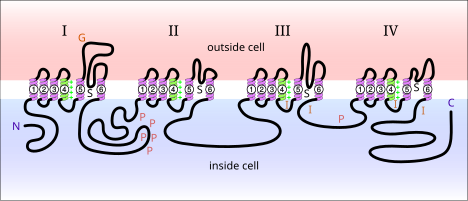
Los canales de sodio dependientes de voltaje son proteínas que se encuentran en la membrana de las neuronas. Cuando se activan eléctricamente, permiten el movimiento de iones de sodio a través de una membrana plasmática . Estos canales son responsables de la propagación de señales eléctricas en las células nerviosas. Los canales de sodio dependientes de voltaje se pueden dividir en dos subunidades: alfa y beta. Se han identificado una variedad de canales de sodio dependientes de voltaje de la subunidad alfa. Los canales de sodio dependientes de voltaje que se encuentran en los mamíferos se pueden dividir en tres tipos: Nav1.x, Nav2.x y Nav3.x. Los canales de sodio Nav1.x están asociados con el sistema nervioso central . Nav1.1, Nav2.2 y Nav1.6 son tres isoformas de los canales de sodio dependientes de voltaje que están presentes en niveles elevados en el sistema nervioso central del cerebro de una rata adulta. [5] Estos canales han sido bien documentados en la membrana axonal del sistema nervioso central. Nav1.2 se ha identificado principalmente en axones no mielinizados, mientras que se han observado altas concentraciones de Nav1.6 en los nódulos de Ranvier de los axones. [6] Nav1.6 se ha identificado en las dendritas de las neuronas CA1 del hipocampo que generan picos dendríticos; la densidad de Nav1.6 en estas neuronas es entre 35 y 80 veces menor que en los segmentos iniciales de los axones. [7]
La distribución de canales de sodio dependientes de voltaje a lo largo de la membrana dendrítica juega un papel crucial en la capacidad de una dendrita para propagar una señal. Los umbrales elevados de la membrana dendrítica a menudo dificultan la iniciación de picos dendríticos. Sin embargo, el aumento de la densidad de los canales de sodio dependientes de voltaje puede reducir la amplitud de una señal necesaria para iniciar un pico. Se ha observado agrupación de canales de sodio dependientes de voltaje en las sinapsis de la neurona del globo pálido . [8] También se ha demostrado mediante modelos computacionales dendríticos que la amplitud umbral de una conductancia sináptica necesaria para generar un pico dendrítico es significativamente menor si los canales de sodio dependientes de voltaje están agrupados en la sinapsis. [8] El mismo tipo de canales dependientes de voltaje puede diferir en la distribución entre el soma y la dendrita dentro de la misma neurona. Parece no haber un patrón general de distribución para los canales dependientes de voltaje dentro de las dendritas. Las diferentes dendritas neuronales exhiben diferentes patrones de densidad que están sujetos a cambios durante el desarrollo y pueden ser modulados por neurotransmisores . [4]
Al igual que los canales de sodio dependientes de voltaje, los canales de calcio dependientes de voltaje también son proteínas de membrana integrales que se encuentran en la membrana plasmática. Los canales de calcio dependientes de voltaje generan potenciales de acción mediante los mismos mecanismos que los canales de sodio dependientes de voltaje. Se han identificado en las neuronas varios canales de calcio dependientes de voltaje. Los canales de calcio dependientes de voltaje de tipo N y P/Q son los principales subtipos que apoyan la transmisión sináptica. [9] Estos canales se concentran en las terminales nerviosas . Se han encontrado canales de calcio dependientes de voltaje de tipo T y tipo R en las dendritas basales, y se cree que la activación de estos canales durante los estallidos del potencial de acción conduce a la generación de picos de calcio dendrítico. [10] Los canales tipo T y tipo R son todos parte de la clase de subunidad alfa 1 de canales de calcio.
Los diversos tipos de canales de calcio dependientes de voltaje dan como resultado dos formas de activación de voltaje: corrientes de calcio activadas por bajo voltaje (LVA) y activadas por alto voltaje (HVA). En los núcleos cerebelosos profundos, las corrientes de calcio no se distribuyen uniformemente a lo largo de una dendrita. [11] La fuerza relativa de las corrientes de calcio del LVA está significativamente más concentrada en el extremo distal de las dendritas. La distribución desigual de las corrientes de calcio del LVA sugiere el importante papel de las corrientes de calcio del LVA en la integración dendrítica en las entradas sinápticas. [11]

Los canales de potasio dependientes de voltaje son otro conjunto de canales dependientes de voltaje que desempeñan un papel importante en el inicio de picos dendríticos. Los canales de potasio dependientes de voltaje, similares a los canales de sodio y calcio dependientes de voltaje, facilitan el movimiento de cationes a través de la membrana plasmática. Pero a diferencia de los canales de sodio y calcio dependientes de voltaje, el canal de potasio dependiente de voltaje mueve los cationes fuera de la célula, lo que tiene un efecto inhibidor sobre la iniciación de picos dendríticos.
El canal de potasio transitorio dependiente de voltaje de tipo A es un canal específico que desempeña un papel clave en la iniciación de picos dendríticos. La densidad de los canales de sodio y calcio dependientes de voltaje es similar tanto en las dendritas como en los axones; sin embargo, la membrana dendrítica es mucho menos excitable que la membrana axonal. [12] La diferencia en la excitabilidad se puede atribuir a la presencia de estos canales de potasio dependientes de voltaje. Los canales de potasio dependientes de voltaje inhiben la capacidad de las dendritas para generar potenciales de acción y disminuyen la amplitud de las espigas dendríticas al aumentar la distancia desde el soma. La capacidad de los canales de potasio dependientes de voltaje para modular la señalización dendrítica puede tener efectos significativos sobre la plasticidad sináptica .
Los potenciales de acción iniciados en el axón normalmente viajan a lo largo del axón alejándose del soma. Sin embargo, también es posible que un potencial de acción viaje en dirección opuesta, invada el soma y luego descienda por la dendrita como una punta dendrítica. [13] Esta señal retrógrada proporciona información a la sinapsis de que la neurona ha disparado una salida. [4] La eficacia de la señal varía entre los diferentes tipos neuronales. Por ejemplo, la propagación hacia atrás de los potenciales de acción es muy limitada en las células de Purkinje del cerebelo [14], pero es bastante frecuente en las interneuronas de la capa ganglionar media del lóbulo similar al cerebelo de algunos peces. [15]
Los potenciales de acción pueden generarse primero en la dendrita si son estimulados por fuertes entradas sinápticas sincrónicas. [16] La capacidad de una dendrita para iniciar un potencial de acción no sólo depende en gran medida de la entrada sináptica sino también del número de canales activados por voltaje y la densidad de los canales activados por voltaje presentes en la membrana.

El inicio de un pico dendrítico a través de una única entrada sináptica fuerte no garantiza que el pico se propague de manera confiable a largas distancias. [17] Si se activan varias sinapsis simultáneamente, se pueden formar picos dendríticos mediante suma espacial . La suma espacial implica la adición de múltiples señales de entrada, lo que da como resultado una señal más grande y posiblemente un pico dendrítico. Se ha demostrado que las neuronas CA1 del hipocampo producen una propagación confiable de picos dendríticos a través de la suma espacial de múltiples entradas sinápticas. En el hipocampo , las neuronas CA1 contienen dos regiones distintivas que reciben entradas sinápticas excitadoras: la vía perforante (PP) a través del penacho dendrítico apical (500-750 μm desde el soma) y la colateral de Schaffer (SC) a través de las dendritas basales y apicales. (250-500 μm del soma). [17] Los estudios muestran que la estimulación individual de PP o SC no fue suficiente para permitir que un pico dendrítico inicie un potencial de acción. Sin embargo, se demostró que cuando se producía un pico dendrítico debido a estimulaciones PP, la presencia de una estimulación SC determinaba si la señal se propagaría o no al soma. [17]
Las espigas dendríticas se propagan con mayor frecuencia hacia atrás desde el soma hasta las ramas dendríticas distales [ cita requerida ] . La propagación hacia atrás cumple una serie de funciones en la neurona, y estas funciones varían según el tipo de neurona. En general, la propagación hacia atrás sirve para comunicar información de salida a la membrana postsináptica. [4] En muchas neuronas liberadoras de neurotransmisores, la propagación hacia atrás de picos dendríticos señala la liberación de neurotransmisores. [18] Por ejemplo, las células mitrales parecen servir como neuronas de proyección y como interneuronas locales. Si la salida axonal de una célula mitral se bloquea por inhibición somática, los potenciales de acción dendríticos locales hacen que la célula mitral libere neurotransmisores al medio ambiente. [18] La propagación hacia atrás de picos dendríticos se ha demostrado en varios tipos neuronales en el cerebro, pero rara vez se ha estudiado fuera del cerebro [ cita requerida ] . Además de las neuronas del cerebro, se han observado picos dendríticos en las neuronas de la médula espinal [ cita requerida ] .
La propagación hacia adelante de los picos dendríticos se inicia debido a la actividad sináptica y se refiere a la transmisión de la señal hacia el soma. [17] La fuerza de la estimulación sináptica necesaria para generar un pico dendrítico varía entre los tipos neuronales. Las neuronas que reciben relativamente pocas entradas no pueden depender de la suma espacial y, por lo tanto, deben depender de entradas sinápticas más fuertes. Algunas neuronas relativamente no ramificadas, como la neurona del globo pálido, evitan la necesidad de una fuerte entrada sináptica mediante concentraciones aumentadas de canales de sodio dependientes de voltaje en la sinapsis. [8] Otras neuronas más ramificadas, como las neuronas piramidales , dependen de la suma espacial de múltiples entradas para generar picos dendríticos que se propagan hacia adelante. La propagación directa no se comprende bien y se dedica mucha investigación al tema [ cita requerida ] . Es lo que piensan la mayoría de los expertos.
que este fenómeno no ocurre en neuronas fuera del cerebro.

La plasticidad dependiente del tiempo de pico (STDP) se refiere a los cambios funcionales en una neurona y su sinapsis debido a potenciales de acción dependientes del tiempo. Cuando un potencial de acción alcanza la membrana presináptica, abre canales de calcio dependientes de voltaje que provocan una entrada de calcio. La entrada de calcio libera vesículas llenas de neurotransmisores, generalmente glutamato, en la hendidura sináptica . Los neurotransmisores se unen a receptores en la membrana postsináptica abriendo canales activados por ligandos que provocan la despolarización de la membrana.
Los receptores NMDA se encuentran en toda la membrana postsináptica y actúan como detectores de coincidencias. El NMDA detecta tanto el glutamato liberado por las vesículas presinápticas como la despolarización de la membrana postsináptica. El receptor NMDA presenta un bloqueo dependiente del voltaje por parte de iones de magnesio. La despolarización de la membrana postsináptica (es decir, la punta dendrítica que se propaga hacia atrás) hace que el ion magnesio se elimine del canal, favoreciendo la apertura del canal. La activación del receptor NMDA permite así la entrada de calcio. Las neuronas que "se activan juntas se conectan entre sí" se refieren al fortalecimiento de las conexiones sinápticas a través de los receptores NMDA cuando la liberación de glutamato coincide con la despolarización postsináptica. [3] Esta forma de cableado se conoce como potenciación a largo plazo . La conexión sináptica también puede debilitarse cuando la actividad de las neuronas no está correlacionada, lo que también se conoce como depresión prolongada .
La dependencia de la despolarización postsináptica en STDP indica la importancia de los picos dendríticos. En general, la despolarización postsináptica ocurre simultáneamente con la actividad presináptica cuando una señal que se propaga hacia atrás llega a la membrana postsináptica. Los picos dendríticos permiten que las señales que se propagan hacia atrás alcancen y despolaricen la membrana postsináptica. El fortalecimiento y debilitamiento de las conexiones sinápticas es un método propuesto para la formación y el aprendizaje de la memoria.
La liberación de glutamato de dos fotones, un tipo de fotoestimulación , se ha convertido en la principal herramienta para estudiar los picos dendríticos debido a su alto nivel de precisión. [19]

La grabación con pinza de parche se utiliza para medir la actividad eléctrica en las neuronas. La técnica utiliza una micropipeta de vidrio con punta abierta de un micrómetro de diámetro para aspirar la membrana de una célula. La pipeta se llena con una solución iónica y se coloca un cable plateado en la solución para conducir y amplificar las señales eléctricas. La solución iónica se puede variar y se pueden administrar medicamentos a través de la micropipeta para estudiar los efectos de la corriente en diversas condiciones. A menudo se aplican antagonistas de receptores y canales dependientes de voltaje (es decir, níquel utilizado para bloquear los receptores NMDA) para estudiar los efectos de los canales iónicos en la iniciación de picos dendríticos. [10] La inyección de corriente a menudo se combina con grabaciones de abrazadera de parche para observar la modulación de la corriente debido a varios factores experimentales.
También se ha demostrado que los métodos de registro con tetrodos permiten ocasionalmente la observación de potenciales de membrana dendríticas y potenciales de acción dendríticos. [20] Curiosamente, el paradigma de registro crónico que demostró esto también mostró que las propiedades de voltaje dendrítico exhibían mapas espaciales egocéntricos comparables a las neuronas piramidales. Este raro fenómeno puede deberse a una vaina glial [21] que se forma alrededor de las puntas de los tetrodos, creando un mar de alta impedancia, similar a un sello de gigaohmios en las grabaciones de parches , que permite realizar mediciones de voltaje tan pequeñas y localizadas.
Las técnicas de tinción y etiquetado se utilizan a menudo en microscopía para ayudar a identificar estructuras específicas en una célula. La tinción generalmente implica el uso de tintes que son absorbidos por varias estructuras celulares a diferentes velocidades. El etiquetado implica el uso de fluorescencia para identificar moléculas específicas. Los fluoróforos , moléculas fluorescentes, pueden unirse o unirse directamente a un anticuerpo para detectar un objetivo específico. En el caso de picos dendríticos, la tinción y el etiquetado se utilizan para identificar y cuantificar la presencia de ciertos canales dependientes de voltaje. Por ejemplo, se han utilizado anticuerpos policlonales de conejo generados contra secuencias peptídicas sintéticas para identificar la presencia de canales de sodio Nav1.2, Nav1.3 y Nav1.6 en las dendritas de la neurona del globo pálido. [8]
El modelado computacional de neuronas, las redes neuronales artificiales , se ha convertido en una herramienta muy popular en la investigación de las propiedades de la señalización neuronal. Estos modelos se basan en redes neuronales biológicas. El modelado computacional se puede utilizar para estudiar neuronas individuales, grupos de neuronas o incluso redes de neuronas. Este campo ha generado mucho interés y sirve como herramienta para todas las ramas de la investigación en neurociencia, incluida la iniciación de picos dendríticos.