El ácido peroximonofosfórico ( H3PO5 ) es un oxiácido de fósforo . Es un aceite viscoso e incoloro. Sus sales se denominan peroximonofosfatos. Otro ácido peroxifosfórico es el ácido peroxidifosfórico , H4P2O8 .
Los ácidos peroxifosfóricos fueron sintetizados y caracterizados por primera vez en 1910 por Julius Schmidlin y Paul Massini a través de la reacción entre el pentóxido de fósforo y una solución acuosa altamente concentrada de peróxido de hidrógeno . [1] Sin embargo, esta reacción se produce de forma muy vigorosa y es difícil de controlar. Además del pentóxido de fósforo, también se han descrito síntesis a partir de ácido metafosfórico y ácido difosfórico .
Gerrit Toennies describió en 1937 un método menos vigoroso para preparar ácido peroxifosfórico mediante la introducción del disolvente inerte acetonitrilo. Se demostró que este método no era adecuado en éter dietílico o alcohol isoamílico . [2]
El ácido peroxifosfórico generalmente se produce tratando pentóxido de fósforo y peróxido de hidrógeno concentrado dentro de un solvente inerte como acetonitrilo o tetracloruro de carbono . [3] [4]
Un método de preparación es la hidrólisis del peroxidifosfato de potasio o litio en un ácido fuerte como el ácido perclórico. [4] Las sales de peroxidifosfato se pueden obtener por electrólisis de sus respectivas sales de fosfato. [5]
El ácido peroxidifosfórico se obtiene cuando el ácido fosfórico se trata con flúor o se oxida electrolíticamente. [5]
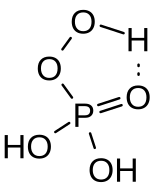
El ácido peroximonofosfórico es un líquido viscoso e incoloro. Se estabiliza mediante un enlace de hidrógeno intramolecular. [6] El compuesto es un ácido triprótico con constantes de disociación ácida pKa1 = 1,1, pKa2 = 5,5 y pKa3 = 12,8. En soluciones acuosas sufre una hidrólisis lenta para formar peróxido de hidrógeno y ácido fosfórico. [7]
Con exceso de agua, la hidrólisis puede considerarse de pseudo-primer orden. La vida media de esta descomposición depende del pH y la temperatura, siendo de aproximadamente 31 horas a 35 °C y de 2,5 horas a 61 °C. [7] Una solución en acetonitrilo también se degrada lentamente, perdiendo el 30% de oxígeno activo después de 26 días de almacenamiento a 5 °C. [6] Se pueden obtener sales relativamente estables por neutralización con bases, por ejemplo con hidróxido de potasio para dar el higroscópico dihidrogenoperoximonofosfato de potasio KH 2 PO 5 . [5]
Los ácidos peroxifosfóricos y los peroxifosfatos tienen pocos usos comerciales. [3]
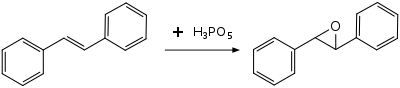
Se han examinado en el contexto de la síntesis orgánica, como un reactivo electrofílico para la oxidación de alquenos , alquinos , compuestos aromáticos y aminas . Debido a la naturaleza fuertemente ácida, solo se pueden preparar epóxidos relativamente estables a los ácidos a partir de alquenos, por ejemplo, óxido de trans -estilbeno a partir de trans -estilbeno. Los epóxidos menos estables se escinden o reaccionan más; el ciclohexeno , el estireno y el α-metilestireno no producen epóxidos aislables. En los casos del estireno y el α-metilestireno, las migraciones de alquilo catalizadas por ácido conducen en cambio a los productos principales ácido fenilacético y ácido 2-fenilpropiónico, respectivamente. [8]
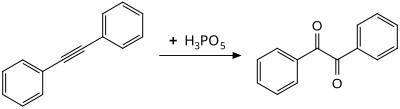
La oxidación del difenilacetileno a temperatura ambiente produce bencilo , presumiblemente a través de un intermedio oxireno . [9]
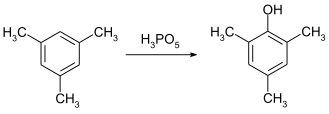
El ácido peroximonofosfórico es un reactivo eficaz para la hidroxilación de anillos aromáticos. La conversión de mesitileno a mesitol se puede lograr a temperatura ambiente en menos de cuatro horas. [10]
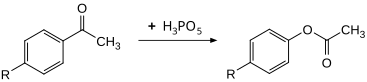
El compuesto puede utilizarse como un agente oxidante eficaz para la oxidación de Baeyer-Villiger . Las acetofenonas sustituidas pueden convertirse en los acetatos de fenilo correspondientes a 30 °C con altos rendimientos. La velocidad es aproximadamente 100 veces mayor en comparación con el uso de ácido peroxibenzoico . [11]
Las aminas aromáticas terciarias como la dimetilanilina se oxidan al óxido de amina correspondiente . [12]

La oxidación de THF con ácido peroximonofosfórico produce γ-butirolactona . [6]