Los péptidos que penetran en las células ( CPP ) son péptidos cortos que facilitan la entrada y la absorción celular de moléculas que van desde partículas de tamaño nanométrico hasta pequeños compuestos químicos y grandes fragmentos de ADN . La "carga" se asocia con los péptidos ya sea a través de enlaces químicos mediante enlaces covalentes o mediante interacciones no covalentes . [1]
Los CPP transportan la carga a las células, generalmente a través de endocitosis , para su uso en investigación y medicina. Su uso actual está limitado por la falta de especificidad celular en la entrega de carga mediada por CPP y por la comprensión insuficiente de los modos de su absorción. Otros mecanismos de entrega que se han desarrollado incluyen CellSqueeze y electroporación . [ cita requerida ]
Los CPP suelen tener una composición de aminoácidos que contiene una abundancia relativa alta de aminoácidos con carga positiva, como la lisina o la arginina , o tiene secuencias que contienen un patrón alterno de aminoácidos polares con carga y aminoácidos no polares e hidrofóbicos . [2] Estos dos tipos de estructuras se denominan policatiónicos o anfipáticos , respectivamente. Una tercera clase de CPP son los péptidos hidrofóbicos, que contienen solo residuos apolares con baja carga neta o grupos de aminoácidos hidrofóbicos que son cruciales para la captación celular. [3] [4]
El activador transcripcional transactivador (TAT), del virus de inmunodeficiencia humana 1 (VIH-1), fue el primer CPP descubierto. En 1988, dos laboratorios descubrieron de forma independiente que el TAT podía ser absorbido de forma eficiente del medio circundante por numerosos tipos de células en cultivo . [5] Desde entonces, el número de CPP conocidos se ha ampliado considerablemente y se han generado análogos sintéticos de moléculas pequeñas con propiedades de transducción de proteínas más eficaces . [6]
Un descubrimiento reciente encontró que los Papillomaviridae , como el virus del papiloma humano , utilizan CPP para penetrar la membrana intracelular y desencadenar el tráfico retrógrado de la unidad viral al núcleo. [7]
Los péptidos que penetran en las células tienen diferentes tamaños, secuencias de aminoácidos y cargas, pero todos los CPP tienen la capacidad de translocar la membrana plasmática y facilitar la entrega de diversas cargas moleculares al citoplasma o a un orgánulo . [1] No existe un consenso real que explique el mecanismo de translocación, pero los candidatos pueden clasificarse en tres mecanismos: penetración directa en la membrana, entrada mediada por endocitosis y translocación a través de una estructura transitoria. La transducción de CPP es un área de investigación en curso. [8] [9]
Los péptidos que penetran en las células (CPP) son capaces de transportar distintos tipos de moléculas de carga a través de la membrana plasmática, por lo que actúan como vehículos de transporte molecular. Tienen numerosas aplicaciones en medicina como agentes de administración de fármacos en el tratamiento de distintas enfermedades, entre ellas el cáncer y los inhibidores de virus, así como agentes de contraste para el marcaje celular. Algunos ejemplos de estos últimos incluyen actuar como portadores de GFP , agentes de contraste para resonancia magnética o puntos cuánticos . [10]
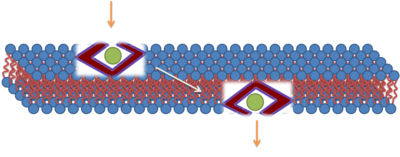
La mayoría de las primeras investigaciones sugirieron que la translocación de CPP policatiónicos a través de las membranas biológicas se producía mediante un proceso celular independiente de la energía. Se creía que la translocación podía progresar a 4 °C y que probablemente implicaba una interacción electrostática directa con fosfolípidos cargados negativamente . Los investigadores propusieron varios modelos en un intento de dilucidar el mecanismo biofísico de este proceso independiente de la energía. Aunque los CPP promueven efectos directos sobre las propiedades biofísicas de los sistemas de membrana puros, la identificación de artefactos de fijación al utilizar CPP de sonda marcados con fluorescencia provocó una reevaluación de los mecanismos de importación de CPP. [11] Estos estudios promovieron la endocitosis como vía de translocación. Se ha propuesto un ejemplo de penetración directa para TAT. El primer paso en este modelo propuesto es una interacción con la proteína de fusión desplegada (TAT) y la membrana a través de interacciones electrostáticas, que interrumpen la membrana lo suficiente como para permitir que la proteína de fusión la cruce. Después de la internalización, la proteína de fusión se repliega debido al sistema de chaperona. No hubo consenso sobre este mecanismo y se han sugerido otros mecanismos que involucran la endocitosis dependiente de clatrina. [12] [13]
Se han propuesto muchos métodos más detallados de captación de CPP, incluida la formación de poros transitorios. [14] [15] [16] [17] [18] Este mecanismo implica fuertes interacciones entre los péptidos que penetran en las células y los grupos fosfato en ambos lados de la bicapa lipídica, la inserción de cadenas laterales de arginina cargadas positivamente que nuclean la formación de un poro transitorio, seguida de la translocación de los péptidos que penetran en las células mediante difusión en la superficie del poro. Este mecanismo explica cómo los ingredientes clave, como la cooperación entre los péptidos, la gran carga positiva y, específicamente, los grupos guanidinio, contribuyen a la captación. El mecanismo propuesto también ilustra la importancia de las fluctuaciones de la membrana. De hecho, los mecanismos que implican grandes fluctuaciones de la estructura de la membrana, como los poros transitorios y la inserción de cadenas laterales de aminoácidos cargadas, pueden ser comunes y quizás centrales para las funciones de muchas proteínas de membrana.

La endocitosis es el segundo mecanismo responsable de la internalización celular. La endocitosis es el proceso de ingestión celular por el cual la membrana plasmática se pliega hacia adentro para introducir sustancias en la célula. Durante este proceso, las células absorben material del exterior de la célula al imbuirse de su membrana celular. La clasificación de la localización celular mediante fluorescencia o por inhibidores de endocitosis es la base de la mayoría de los estudios. Sin embargo, el procedimiento utilizado durante la preparación de estas muestras genera información cuestionable con respecto a la endocitosis. Además, los estudios muestran que la entrada celular de penetratina por endocitosis es un proceso dependiente de la energía. Este proceso se inicia mediante la interacción de poliargininas con heparán sulfatos que promueven la endocitosis. Las investigaciones han demostrado que la TAT se internaliza a través de una forma de endocitosis llamada macropinocitosis. [19] [20]
Los estudios han demostrado que la endocitosis está involucrada en la internalización de los CPP, pero se ha sugerido que podrían ocurrir diferentes mecanismos al mismo tiempo. Esto se establece por el comportamiento informado para la penetratina y el transportano, en el que tanto la translocación de membrana como la endocitosis ocurren simultáneamente. [21] [22]

El tercer mecanismo responsable de la translocación se basa en la formación de micelas invertidas . Las micelas invertidas son agregados de surfactantes coloidales en los que los grupos polares se concentran en el interior y los grupos lipofílicos se extienden hacia el exterior en el disolvente. Según este modelo, un dímero de penetratina se combina con los fosfolípidos cargados negativamente, generando así la formación de una micela invertida en el interior de la bicapa lipídica. La estructura de las micelas invertidas permite que el péptido permanezca en un entorno hidrofílico. [23] [24] [25] No obstante, este mecanismo sigue siendo motivo de discusión, porque la distribución de la penetratina entre la membrana interna y externa es asimétrica. Esta distribución asimétrica produce un campo eléctrico que ha sido bien establecido. El aumento de la cantidad de péptido en las láminas externas hace que el campo eléctrico alcance un valor crítico que puede generar un evento similar a la electroporación.
El último mecanismo implica que la internalización ocurre por péptidos que pertenecen a la familia de péptidos anfipáticos primarios, MPG y Pep-1. Se han propuesto dos modelos similares basados en estudios fisicoquímicos, que consisten en dicroísmo circular, infrarrojo por transformada de Fourier y espectroscopia de resonancia magnética nuclear. Estos modelos están asociados con mediciones electrofisiológicas e investigaciones que tienen la capacidad de imitar membranas modelo como monocapa en la interfaz aire-agua. La estructura que da lugar a los poros es la principal diferencia entre el modelo propuesto de MPG y Pep-1. En el modelo de MPG, el poro está formado por una estructura de barril b, mientras que Pep-1 está asociado con hélices. Además, se han descubierto fuertes interacciones hidrofóbicas de fosfolípidos y péptidos en ambos modelos. [26] [27] En los dos modelos de péptidos, las partes plegadas de la molécula portadora se correlacionan con el dominio hidrofóbico, aunque el resto de la molécula permanece sin estructurar. [28]

La translocación facilitada por péptidos que penetran en las células es un tema de gran debate. Se han presentado pruebas de que la translocación podría utilizar varias vías diferentes para su captación. Además, el mecanismo de translocación puede depender de si el péptido está libre o unido a una carga. La captación cuantitativa de CPP libre o unido a una carga puede variar mucho, pero los estudios no han demostrado si este cambio es resultado de la eficiencia de la translocación o de la diferencia en la vía de translocación. Es probable que los resultados indiquen que varios mecanismos de CPP compiten y que varias vías contribuyen a la internalización de CPP. [29]
Las macromoléculas basadas en ácidos nucleicos, como el ARNi, el oligonucleótido antisentido, el ADN señuelo y los plásmidos, son terapias biológicas y farmacológicas prometedoras para la regulación de la expresión génica. [30] [31] [32] Sin embargo, a diferencia de otros fármacos de moléculas pequeñas, su desarrollo y aplicaciones están limitados por el alto peso molecular y las cargas negativas, lo que da como resultado una eficiencia de absorción deficiente y un bajo tráfico celular. Para superar estos problemas, se han desarrollado varios sistemas de administración diferentes, incluido el conjugado de CPP-ácido nucleico, que es una herramienta poderosa.


La mayoría de los complejos de CPP-ácido nucleico que se han propuesto hasta ahora se forman a través de enlaces covalentes. Se ha sintetizado una variedad de complejos de CPP-ácido nucleico a través de diferentes químicas que son enlaces estables o escindibles. Y el método más utilizado en la publicación son los enlaces disulfuro escindibles a través de la síntesis total en fase sólida por pasos o el acoplamiento de fragmentos en fase sólida o en solución. [33] También se han desarrollado otras estrategias como el enlace amida estable, tiazolidina, oxima e hidrazina. [34] Sin embargo, esos métodos de enlace covalente están limitados por la preocupación de que el enlace covalente sintético entre CPP y ácido nucleico puede alterar la actividad biológica de este último. [35] Por lo tanto, se ha aplicado con éxito una nueva estrategia no covalente que no requiere modificación química con CPP anfipáticos cortos, como MPG y Pep-1 como portadores para la entrega de cargas. [36] [37] Estos conjugados no covalentes se forman a través de interacciones electrostáticas o hidrófobas. Con este método, cargas como ácidos nucleicos y proteínas podrían transportarse de manera eficiente, manteniendo al mismo tiempo la actividad biológica completa.
El ARN interferente corto (siRNA) es una nueva herramienta poderosa que puede interferir y silenciar la expresión de genes patológicos específicos. [38] Para mejorar la captación celular de siRNA, se han aplicado estrategias de CPP para facilitar la administración de siRNA a las células a través de enlaces covalentes o no covalentes. En un estudio, el siRNA se une covalentemente a transportan y penetratina mediante un enlace disulfuro en el extremo 5' de las cadenas de sentido del siRNA para dirigirse a los reporteros de ARNm de luciferasa o eGFP. [39] En otro estudio, el conjugado TAT-siRNA a través de un enlace tiomaleimida estable en el extremo 3' del siRNA se administró a células HeLa para el silenciamiento del gen eGFP. [40]
Sin embargo, las estrategias no covalentes parecen ser mejores para la administración de ARNi con una respuesta biológica más significativa. En un estudio, los complejos MPG/ARNi formados a través de una estrategia no covalente estable mostraron una introducción exitosa de ARNi en células cultivadas e indujeron una regulación robusta del ARNm objetivo. [37] Además, los complejos MPG/ARNi también se han aplicado para la administración de ARNi in vivo en blastocitos de ratón para la regulación genética. [41] El MPG forma complejos estables con ARNi con una baja tasa de degradación y se puede funcionalizar fácilmente para una orientación específica, que son ventajas importantes en comparación con la tecnología CPP covalente.
La administración de ARNi a células representa una herramienta valiosa para el tratamiento de enfermedades oncológicas, infecciones virales y trastornos genéticos. Sin embargo, las estrategias clásicas implican la unión covalente de moléculas de carga y CPP, lo que no proporciona una protección eficiente de las moléculas de ARNi in vivo ; por lo tanto, los resultados informados en la literatura no son consistentes. Recientemente, se han informado con éxito estrategias no covalentes. Se han informado péptidos anfipáticos secundarios basados en residuos aromáticos de triptófano y arginina unidos con lisina como espaciador bajo el nombre de CADY. CADY contiene una secuencia peptídica corta de 20 aminoácidos, con la secuencia “Ac-GLWRALWRLLRSLWRLLWRA-cisteamida”. [42] Este péptido es capaz de autoensamblarse en forma helicoidal con residuos hidrófilos e hidrófobos en diferentes lados de la molécula, tiene dos orientaciones diferentes de la superficie que representan la energía más baja y es capaz de formar complejos con siRNA en diferentes proporciones molares que varían de 1:1 a 80:1. CADY es capaz de formar un escudo alrededor de la molécula de siRNA protegiéndola de los procesos biodegradativos que pueden ocurrir antes de que ocurra la penetración celular. Este tipo de sustratos pueden presentar importantes aplicaciones in vivo .
Los oligonucleótidos antisentido (asON) se han utilizado en la investigación básica y se están desarrollando como posibles tratamientos médicos. Se han desarrollado estrategias de CPP para administrar oligómeros antisentido como PNA y PMO a las células. Al superar la repulsión de la membrana celular de los ON con carga negativa y la degradación de los asON por enzimas, los CPP aumentan la biodisponibilidad de los asON. Dos tipos de análogos de ON neutros, el ácido nucleico peptídico ( PNA ) y los oligómeros de morfolino fosforodiamidato (PMO o Morfolino ) se están volviendo dominantes en esta área. El PNA se ha conjugado con varios CPP ya sea a través de enlaces disulfuro o a través de enlaces amida estables. [43] Por ejemplo, se observó actividad antisentido dentro de las células que bloqueaba la expresión del receptor de galanina cuando un PNA de 21 meros se acopló a la penetratina. [44] También se han informado resultados sobre la actividad antiviral con PNA dirigido al VIH-1 a través de enlaces disulfuro con TAT. [45] Los conjugados CPP-PMO también se han utilizado con éxito para inhibir la replicación de varios virus como el SARS [46] y la influenza [47] y la unión de CPP ha mejorado la eficacia de los morfolinos modificadores de empalme en el desarrollo para el tratamiento de la distrofia muscular de Duchenne [48].
El ADN señuelo es un ADN de doble cadena exógeno (dsDNA), que puede imitar una secuencia promotora que puede inhibir la actividad de un factor de transcripción específico. [49] Pero el dsDNA tiene el mismo problema que otros agentes terapéuticos, la biodisponibilidad deficiente. En un estudio, los CPP TP y TP10 se acoplaron al ADN señuelo NFкB, lo que bloqueó el efecto de la activación de NFкB inducida por interleucina-1 y la expresión del gen IL-6. [50] En otro estudio, el ADN señuelo Myc acoplado a TP10 disminuyó la capacidad proliferativa de las células N2a. [51]
Se pueden insertar genes individuales en sitios específicos de plásmidos y se pueden introducir plásmidos recombinantes en células vivas. Se ha propuesto un método que utiliza TAT macroramificado para la administración de ADN plasmídico a varias líneas celulares y ha demostrado capacidades de transfección significativas. [52] Se ha descubierto que los multímeros de TAT aumentan la eficiencia de transfección del ADN plasmídico entre 6 y 8 veces más que la poli-L-arginina o el mutante TAT2-M1, y 390 veces más que los vectores estándar. [53]
El desarrollo de proteínas terapéuticas, que ha representado un método valioso para tratar enfermedades, está limitado por la baja eficiencia de los métodos de administración tradicionales. Se ha descubierto que la evaluación de la administración citosólica de proteínas unidas a CPP es propensa a artefactos [54] y, por lo tanto, requiere el uso de métodos de evaluación que distingan la administración citosólica verdadera de las proteínas CPP unidas a la superficie celular o atrapadas en el endosoma. [55] [56] Recientemente, se han informado varios métodos que utilizan CPP como vehículos para administrar proteínas biológicamente activas de longitud completa a células y animales vivos.
Varios grupos han administrado con éxito proteínas fusionadas con CPP in vitro . TAT pudo administrar diferentes proteínas, como la peroxidasa de rábano picante y la ARNasa A a través de la membrana celular hacia el citoplasma en diferentes líneas celulares in vitro . El rango de tamaño de las proteínas con administración efectiva es de 30 kDa a 120-150 kDa. En un estudio, las proteínas fusionadas con TAT se internalizan rápidamente por macropinocitosis dependiente de balsa lipídica utilizando un ensayo de reportero de recombinasa TAT-Cre transducible en células vivas. [57] En otro estudio, una proteína fusionada con TAT se administró a las mitocondrias de células de cáncer de mama y disminuyó la supervivencia de las células de cáncer de mama, lo que mostró la capacidad de las proteínas de fusión con TAT para modular la función mitocondrial y la supervivencia celular. Además, cR10, una CPP de poliarginina cíclica, permitió la transducción independiente de endocitosis de proteínas de unión a antígeno a través de la membrana celular con biodisponibilidad inmediata. De esta manera, los autores del estudio pudieron introducir proteínas fluorescentes de unión a antígenos en las células, lo que facilitó la inmunotinción de células vivas. [58] Sin embargo, pocos estudios in vivo han tenido éxito. En un estudio, la administración in vivo de fragmentos Fab reticulados con TAT o penetratina produjo distribuciones de órganos variadas y un aumento general en la retención de órganos, lo que mostró la localización del tejido. [59]
También se ha desarrollado un método no covalente que forma complejos de CPP/proteína para abordar las limitaciones de los métodos covalentes, como la modificación química antes de la reticulación y la desnaturalización de las proteínas antes de la administración. En un estudio, un transportador de péptidos anfipático corto, Pep-1, y complejos proteicos han demostrado ser eficaces para la administración. Se demostró que Pep-1 podría facilitar la rápida absorción celular de varios péptidos, proteínas e incluso anticuerpos de longitud completa con alta eficiencia y menos toxicidad. Este enfoque ha simplificado enormemente la formulación de reactivos. [60]


Los CPP se utilizan como transportadores de agentes de contraste a través de las membranas plasmáticas. Estos agentes de contraste pueden marcar las células tumorales, lo que hace que los compuestos sean herramientas importantes en el diagnóstico del cáncer; también se utilizan en experimentos celulares in vivo e in vitro . Las clases más importantes de CPP se aíslan de virus, como TAT (transcripción transactivada) derivada del VIH-1, penetratina y transportan. Los CPP más utilizados se basan en derivados de TAT. TAT es un CPP rico en arginina. Varias mejoras para este sustrato incluyen el uso de aminoácidos β o γ no naturales. Esta estrategia ofrece múltiples ventajas, como la resistencia a la degradación proteolítica, un proceso de degradación natural por el cual los enlaces peptídicos se hidrolizan a aminoácidos. La inserción de ácidos no naturales en la cadena peptídica tiene múltiples ventajas. Facilita la formación de foldámeros estables con una estructura secundaria distinta. [61] [62] [63] Los β-péptidos son conformacionalmente más estables en solución acuosa que los péptidos naturales, especialmente para cadenas pequeñas. La estructura secundaria se refuerza por la presencia de un β-aminoácido rígido, que contiene fragmentos de ciclohexano o ciclopentano. Estos fragmentos generan una estructura más rígida e influyen en el ángulo de apertura del foldámero. Estas características son importantes para el diseño de nuevos péptidos. Los β-péptidos helicoidales imitan las actividades antimicrobianas de los péptidos de defensa del huésped. [64] [65] [66] Esta característica requiere la orientación de los residuos catiónicos-hidrófilos en un lado y los hidrófobos en el otro lado de la hélice. La unión del grupo fluorescente en una cabeza de la molécula confiere propiedades de contraste. Una nueva estrategia para mejorar la capacidad de captación celular de CPP se basa en la asociación de dominios policatiónicos y polianiónicos que están separados por un enlazador. La asociación celular de residuos policatiónicos (poliarginina) con células de membrana cargadas negativamente se bloquea de manera efectiva mediante la presencia de residuos polianiónicos (ácido poliglutámico) y el enlazador, que confieren la distancia adecuada entre estos dos residuos cargados para maximizar su interacción. Estos péptidos adoptan una estructura de horquilla, confirmada por la correlación del efecto Overhauser para las proximidades protón-protón de las dos fracciones cargadas. En esta etapa, solo el enlazador se expone a la hidrólisis de proteasas en aplicaciones in vivo. La hidrólisis del enlazador ocurre y los dos fragmentos cargados experimentan una mayor libertad conformacional. En ausencia del enlazador, el péptido catiónico puede interactuar de manera más eficiente con la célula diana y la captación celular ocurre antes de la proteólisis. Esta estrategia encontró aplicaciones en el etiquetado de células tumorales in vivo.Las células tumorales se marcaron en minutos. La degradación del ligador se puede predecir por la cantidad de D-aminoácidos (el isómero no natural) incorporado en la cadena peptídica, lo que restringe la proteólisis in vivo al ligador central. [67] [68] [69] [70]

Los puntos cuánticos (QD) representan una clase relativamente nueva de sondas fluorescentes que tienen propiedades ópticas superiores a las de los colorantes orgánicos clásicos basados en grupos fluorescentes. Las principales ventajas de los QD incluyen altos rendimientos cuánticos, amplios espectros de absorción, espectros de emisión ajustables por tamaño y buena resistencia a la degradación química y fotoquímica. Las pruebas in vivo han demostrado que varios péptidos cargados positivamente (basados en residuos de guanidina) pueden atravesar las membranas celulares y promover la captación celular de moléculas adheridas, incluidos los puntos cuánticos. Las propiedades de los QD se pueden modificar fácilmente cambiando los sustratos orgánicos unidos a ellos, lo que ofrece una herramienta biológica versátil como marcadores celulares. Se están realizando investigaciones para optimizar las metodologías para la administración intracelular de QD y bioconjugados de QD, y la caracterización de las propiedades fotofísicas in vivo a largo plazo. [71] [72] [73] [74] [75]
Los puntos cuánticos son nanocristales coloidales, basados en un núcleo de cadmio-selenio (CdSe) cubierto con una capa de zinc-azufre (ZnS). Este sustrato se ha utilizado intensivamente como marcador celular porque el CdSe emite en el dominio visible y es un excelente agente de contraste, mientras que la capa de ZnS protege el núcleo de la oxidación y también de la lixiviación de CdSe en la solución circundante. Esta estrategia también mejora el rendimiento de la fotoluminiscencia. Las propiedades se pueden ajustar mediante el espesor de las capas protectoras de ZnS. La emisión coloidal de QD se puede modular desde UV-Vis hasta infrarrojo utilizando diferentes tipos de agentes de recubrimiento, como ZnS, CdS, ZnSe, CdTe y PbSe. Las propiedades de los puntos cuánticos también se pueden ajustar mediante el esquema sintético, mezclas de solvente/ligando de alta temperatura que influyen en las propiedades del nanocristal. Los agentes de contraste de QD de alta calidad se obtienen a temperaturas elevadas; Sin embargo, debido a que tienen una menor solubilidad en agua, su uso como marcadores celulares es limitado. Se requiere una mayor funcionalización con ligandos hidrófilos. [76] [73]
Las ventajas de los QD se deben a su rápida acción; son capaces de marcar un tejido o célula objetivo en segundos. Los estudios in vivo muestran que los QD pueden marcar selectivamente células cancerosas y se acumulan en los sitios tumorales. Las células tumorales marcadas con QD pueden rastrearse con microscopía multifotónica a medida que invaden el tejido pulmonar. En ambos estudios, la obtención de imágenes espectrales y la sustracción autofluorescente permitieron la visualización multicolor in vivo de células y tejidos. Una desventaja importante de los QD es su toxicidad relativamente alta. Se están realizando funcionalizaciones con diferentes sustratos que aumentan la bioafinidad y disminuyen la toxicidad. Por ejemplo, el azufre de la capa del QD puede formar enlaces disulfuro reversibles con una amplia clase de compuestos orgánicos. [77]

La resonancia magnética (RM) es una herramienta poderosa para el diagnóstico de enfermedades como la metástasis del cáncer y la inflamación, utilizando diferentes quelatos metálicos . Los quelatos metálicos aumentan la señal de contraste entre los tejidos normales y enfermos al catalizar la relajación de los protones de agua en sus proximidades. Ejemplos típicos son los quelatos de bajo peso molecular Gd3+ y el óxido de hierro superparamagnético (SPIO). La administración in vivo de estos agentes permite el marcado de células tumorales; o las células pueden marcarse in vitro con agentes de contraste y luego pueden inyectarse y monitorearse in vivo utilizando técnicas de RM. [78] [79] [80]
Las nanopartículas SPIO confieren alta sensibilidad en la resonancia magnética pero tienen menor afinidad por las células; funcionan en altas concentraciones. Las funcionalizaciones de estos compuestos utilizando guanidinas dendrímeras mostraron actividades similares a las de las CPP basadas en TAT pero mayor toxicidad. Los nuevos sustratos basados en dendrones con periferias de hidroxilo o amina muestran baja toxicidad. Las aplicaciones de SPIO incluyen el marcaje celular in vivo ; debido a su baja toxicidad, están aprobados clínicamente para su uso en imágenes del hígado , el bazo y el tracto gastrointestinal. [81]
La presencia de residuos de arginina octamérica permite la transducción de la membrana celular de varias moléculas de carga, incluidos péptidos, ADN, ARNi y agentes de contraste. Sin embargo, la capacidad de atravesar la membrana no es unidireccional; los CPP basados en arginina pueden entrar y salir de la membrana celular, mostrando una concentración general decreciente de agente de contraste y una disminución de la señal de resonancia magnética (RM) en el tiempo. Esto limita su aplicación in vivo . Para resolver este problema, los agentes de contraste con disulfuro, enlace reversible entre el quelato metálico y la fracción de transducción mejoran la retención asociada a la célula. El enlace disulfuro se reduce por el entorno de la célula diana y el quelato metálico permanece atrapado en el citoplasma, lo que aumenta el tiempo de retención del quelato en la célula diana. [82] [83] [84] [85]