La reacción de Prilezhaev , también conocida como reacción de Prileschajew o epoxidación de Prilezhaev , es la reacción química de un alqueno con un peroxiácido para formar epóxidos . [1] Lleva el nombre de Nikolai Prilezhaev , quien informó por primera vez esta reacción en 1909. [2] Un peroxiácido ampliamente utilizado para esta reacción es el ácido meta -cloroperoxibenzoico ( m -CPBA), debido a su estabilidad y buena solubilidad en la mayoría de los disolventes orgánicos. [1] [3] La reacción se realiza en disolventes inertes ( C 6 H 14 , C 6 H 6 , CH 2 Cl 2 , CHCl 3 , CCl 4 ) entre -10 y 60 °C con un rendimiento del 60-80%.
Un ejemplo ilustrativo es la epoxidación de trans -2-buteno con m -CPBA para dar trans -2,3-epoxibutano : [4]

El átomo de oxígeno que se añade a través del doble enlace del alqueno se toma del peroxiácido, lo que genera una molécula del ácido carboxílico correspondiente como subproducto. La reacción es altamente estereoespecífica en el sentido de que la estereoquímica del doble enlace generalmente se transfiere a la configuración relativa del epóxido con una fidelidad esencialmente perfecta, de modo que una trans -olefina conduce a la formación estereoselectiva del epóxido trans -2,3-sustituido solamente, como se ilustra en el ejemplo anterior, mientras que una cis -olefina solo daría el cis- epóxido. Este resultado estereoquímico es una consecuencia del mecanismo aceptado, que se analiza a continuación.
En general, la reacción de Prilezhaev epoxida el doble enlace más sustituido. [1]
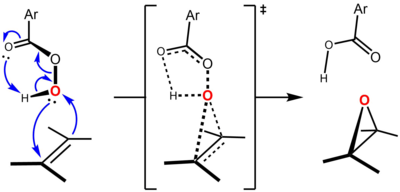
La reacción se lleva a cabo a través de lo que se conoce comúnmente como el "mecanismo de mariposa", propuesto por primera vez por Bartlett, en el que el perácido está unido por enlaces de hidrógeno intramoleculares en el estado de transición. [5] Aunque hay interacciones orbitales de frontera en ambas direcciones, el perácido generalmente se considera como el electrófilo y el alqueno como el nucleófilo . En apoyo de esta noción, los alquenos más ricos en electrones experimentan epoxidación a una velocidad más rápida. Por ejemplo, las velocidades relativas de epoxidación aumentan tras la sustitución de metilo del alqueno (los grupos metilo aumentan la densidad electrónica del doble enlace por hiperconjugación ): etileno (1, sin grupos metilo), propeno (24, un grupo metilo), cis -2-buteno (500, dos grupos metilo), 2-metil-2-buteno (6500, tres grupos metilo), 2,3-dimetil-2-buteno (>6500, cuatro grupos metilo).
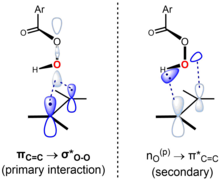
Se cree que la reacción es concertada, con un estado de transición que es sincrónico o casi sincrónico. [6] El "mecanismo de mariposa" tiene lugar a través de una geometría de estado de transición en la que el plano del perácido biseca el del alqueno, con el enlace O-O alineado perpendicularmente a él. Esta conformación permite que se produzcan las interacciones orbitales fronterizas clave. La interacción primaria del orbital π C=C ocupado (HOMO) y el orbital σ* OO desocupado de baja altitud (LUMO). Esta interacción explica el carácter nucleofílico general observado y el carácter electrofílico del alqueno y el perácido, respectivamente. También hay una interacción secundaria entre un orbital de par solitario perpendicular al plano del perácido, n O (p) (HOMO) y el orbital π* C=C desocupado (LUMO). [7] [8] Utilizando el enfoque de Anslyn y Dougherty (2006, p. 556), el mecanismo se puede representar de la siguiente manera: [9]
Existe una gran dependencia de la velocidad de reacción con la elección del disolvente. [10]