La oxidación de Rubottom es una reacción química útil y de alto rendimiento entre éteres de sililo enol y peroxiácidos para dar el producto de α-hidroxicarbonilo correspondiente. [1] [2] [3] [4] [5] El mecanismo de la reacción fue propuesto en su divulgación original por AG Brook [6] [7] con evidencia adicional proporcionada posteriormente por George M. Rubottom. [8] Después de una oxidación de tipo Prilezhaev del éter de sililo enol con el peroxiácido para formar el intermedio de siloxi oxirano , la apertura del anillo catalizada por ácido produce un ion oxocarbenio . [1] [4] Este intermedio participa luego en una migración de 1,4-sililo ( transposición de Brook ) para dar un derivado de α-siloxicarbonilo que se puede convertir fácilmente en el compuesto de α-hidroxicarbonilo en presencia de ácido, base o una fuente de fluoruro. [1] [9] [10]
En 1974, tres grupos independientes informaron sobre la reacción ahora conocida como oxidación de Rubottom: [1] AG Brook, [6] A. Hassner, [11] y GM Rubottom. [12] Ya existía un precedente considerable para la reacción. [3] Por ejemplo, ya se sabía en la década de 1930 que los compuestos β-dicarbonílicos altamente enolizables reaccionarían con peroxiácidos, aunque no fue hasta las décadas de 1950 y 1960 que los compuestos α-hidroxi β-dicarbonílicos fueron de hecho el producto. [13] [14]
Importante trabajo de AG Brook, durante la década de 1950 sobre los mecanismos de migraciones de organosilicio, que ahora se conocen como Reordenamientos de Brook . [15] [16] En 1974, CH Heathcock describió la ozonólisis de éteres de enol de sililo para dar un producto de ácido carboxílico a través de escisión oxidativa donde las migraciones de sililo se observaron como reacciones secundarias y exclusivamente en el caso de un sistema bicíclico. [17]
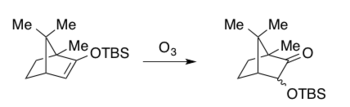
Las implementaciones originales de la oxidación de Rubottom presentaban el ácido meta-cloroperoxibenzoico peroxiácido (mCPBA) como oxidante en diclorometano (DCM), en el caso de Hassner y Brook, y hexanos para Rubottom. [6] [11] [12] Si bien la reacción se ha ajustado y modificado desde 1974, el mCPBA todavía se usa comúnmente como oxidante con una variación ligeramente mayor en la elección del solvente. [1] [4] El DCM sigue siendo el solvente más común, seguido de varios solventes de hidrocarburos, incluidos el pentano y el tolueno. [1] [4] En particular, la reacción se produce a temperaturas relativamente bajas y no es necesario calentar más allá de la temperatura ambiente. [1] [4] Las bajas temperaturas permiten que las condiciones de oxidación estándar de Rubottom sean adecuadas con una variedad de funcionalidades sensibles, lo que lo hace ideal para la síntesis de moléculas complejas (ver ejemplos sintéticos a continuación). Los sustratos de éteres de sililo enol se pueden preparar de forma regioselectiva a partir de cetonas o aldehídos empleando un control termodinámico o cinético de la enolización antes de atraparlos con la fuente de organosilicio deseada (normalmente un cloruro o triflato, p. ej., TBSCl o TBSOTf). [18] Como se ilustra en los ejemplos sintéticos a continuación, los éteres de sililo enol se pueden aislar antes de la exposición a las condiciones de reacción, o el material crudo se puede someter inmediatamente a oxidación sin aislamiento. De esta manera se pueden preparar derivados de éteres de sililo enol tanto acíclicos como cíclicos y, posteriormente, se pueden utilizar como sustratos en la oxidación de Rubottom. [1] A continuación se presentan algunos productos representativos de la oxidación de Rubottom sintetizados en los artículos seminales. [6] [11] [12]

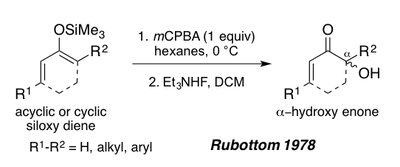
En 1978, Rubottom demostró que los 1,3 dienos siloxi, derivados de enonas acíclicas o cíclicas, también podrían servir como sustratos para la oxidación de Rubottom para forjar α-hidroxi enonas después del tratamiento con fluoruro de trietilamonio. [1] [19] Estos sustratos dan un solo regioisómero en las condiciones de reacción debido a la naturaleza rica en electrones del enlace pi del enol de sililo (ver la síntesis de Periplanona B a continuación). [1]
La oxidación de Rubottom se ha mantenido prácticamente sin cambios desde su divulgación inicial, pero uno de los principales inconvenientes de las condiciones estándar es el entorno ácido, que puede provocar reacciones secundarias no deseadas y degradación. Se suele emplear un sistema de tampón de bicarbonato de sodio simple para aliviar este problema, que es especialmente problemático en las síntesis de moléculas complejas bicíclicas y otras (consulte los ejemplos sintéticos). [1] [20] La introducción de oxidantes quirales también ha permitido la síntesis de derivados de α-hidroxicarbonilo enantiopuros a partir de sus correspondientes éteres de sililo enol. [1] El primer ejemplo de una oxidación enantioselectiva de Rubottom fue publicado por FA Davis [21] en 1987 y mostró la metodología de oxaziridina quiral de Davis ( oxidación de Davis ) para dar buenos rendimientos pero modestos excesos enantioméricos . En 1992, KB Sharpless demostró que las condiciones de dihidroxilación asimétrica desarrolladas en su grupo podían aprovecharse para dar cetonas α-hidroxi (R) o (S) a partir de los éteres enólicos de sililo correspondientes, dependiendo de qué ligandos quirales derivados del alcaloides de Chinchona se emplearan. [22] Los grupos de Y. Shi [23] y W. Adam [24] publicaron otra variante enantioselectiva de la oxidación de Rubottom en 1998 utilizando la cetona quiral Shi en presencia de oxona en un sistema tamponado para proporcionar cetonas α-hidroxi con alto rendimiento y alto exceso enantiomérico . El grupo de Adam también publicó otro artículo en 1998 utilizando complejos de manganeso (III)-(Salen) en presencia de NaOCl (lejía) como oxidante y N-óxido de 4-fenilpiridina como aditivo en un sistema tamponado con fosfato. [25] Esta metodología también proporcionó altos rendimientos y enentioselectividades para los éteres de sililo enol, así como para los acetales de sililo ceteno derivados de ésteres.

Junto con los oxidantes quirales, se han examinado variantes de mCPBA. [1] Stankovic y Espenson publicaron una variación de la oxidación de Rubottom donde se utiliza metiltrioxorrenio como oxidante catalítico en presencia de peróxido de hidrógeno estequiométrico . [1] [26] Esta metodología proporciona cetonas α-hidroxi acíclicas y cíclicas con un alto rendimiento con un oxidante barato y disponible comercialmente. Un problema inherente con mCPBA es su incapacidad para oxidar acetales de sililcetena. Para sintetizar ésteres α-hidroxi, se necesitan diferentes oxidantes como NaOCl (ver arriba), acetato de plomo (IV) o un complejo de ácido hipofluoroso-acetonitrilo (HOF-ACN). [1] [27] El grupo de Rubottom descubrió que el acetato de plomo (IV) en DCM o benceno daba buenos rendimientos de ésteres α-hidroxi acíclicos y cíclicos después del tratamiento de la mezcla de reacción cruda con fluoruro de trietilamonio. [27] Más tarde, S. Rozen utilizó el complejo HOF-ACN altamente electrofílico para oxidar una variedad de éteres de sililo enol ricos en electrones, acetales de sililo ceteno y bis(acetales de sililo), derivados de ácidos carboxílicos, con buenos rendimientos a temperatura ambiente o por debajo de ella. [1] [28]
Los siguientes ejemplos representan solo una pequeña parte de las síntesis que resaltan el uso de la oxidación de Rubottom para instalar una importante funcionalidad α-hidroxi. Algunas de las principales características de las siguientes síntesis incluyen el uso de condiciones amortiguadas para proteger los sustratos sensibles y la instalación diastereoselectiva del grupo α-hidroxi debido al sesgo facial controlado por el sustrato. Para más ejemplos, consulte las referencias [1] [3] [4]
La oxidación de Rubottom se utilizó en la síntesis de periplanona B , una feromona sexual excretada por la cucaracha americana hembra . [29] [30] La síntesis empleó un reordenamiento oxi-Cope aniónico acoplado a una oxidación de Rubottom. Después de calentar en presencia de hidruro de potasio (KH) y 18-corona-6 (18-C-6) para efectuar el oxi-Cope aniónico, el intermedio enolato se atrapó con cloruro de trimetilsililo (TMSCl). El intermedio éter enólico de sililo se pudo tratar luego con mCPBA en condiciones de oxidación de Rubottom para dar el compuesto α-hidroxicarbonilo deseado que luego se pudo llevar a (±)-periplanona B y sus diastereómeros para probar su estructura.

Ghosh y Li sintetizaron brevisamida, un precursor biosintético propuesto para una toxina marina de poliéter, uno de cuyos pasos es una oxidación de Rubottom del éter de sililo enólico cíclico en condiciones amortiguadas. [31] El catalizador de cromo quiral B fue desarrollado por el grupo Jacobsen y confiere altos niveles de enantio- y diastereoselectividad. [32] Los estereocentros convenientemente establecidos en la reacción de Diels-Alder dirigen la oxidación a la cara menos impedida, dando un solo diastereómero, que luego podría llevarse a cabo en 14 pasos más para obtener brevisamida.

Wang y colaboradores desarrollaron una síntesis robusta, a escala de kilogramo, del potente derivado 2S-hidroximutilina a partir de pleuromutilina, un antibiótico producido por varias especies de basidiomicetos . [33] La hidrólisis básica para eliminar la fracción de éster hidroxilo de la pleuromutilina produjo mutilina. El tratamiento posterior con hexametildisilazida de litio (LiHMDS) y TMSCl dio el éter de enol de sililo protegido con TMS, que se sometió inmediatamente a una oxidación de Rubottom amortiguada con ácido acético - (HOAc) piridina - (Py) antes de la hidrólisis ácida para producir 2S-hidroximutilina. Esta secuencia altamente optimizada presenta dos aspectos importantes. Primero, los autores generaron originalmente el éter de enol de sililo usando trietilamina, que dio una mezcla del producto cinético deseado (mostrado a continuación), el producto termodinámico no deseado y la hidrólisis de regreso a mutilina. Los autores culparon a la formación del subproducto ácido trietilamonio (pKa = 10,6) de los productos secundarios no deseados y remediaron esto utilizando el LiHMDS para formar exclusivamente el producto cinético deseado sin reacciones secundarias catalizadas por ácido debido a la acidez significativamente menor del producto protonado (pKa = 26). [34] En segundo lugar, si bien la oxidación se produjo desde la cara convexa deseada del éter enólico de sililo, los autores observaron una cantidad significativa de productos de sobreoxidación que atribuyeron a la estabilidad del intermediario de ion oxocarbenio en condiciones amortiguadas con bicarbonato de sodio. Plantearon la hipótesis de que la mayor vida útil de las especies intermedias permitiría que se produjera la sobreoxidación. Después de una cantidad significativa de optimización, se descubrió que un tampón HOAc/Py atrapaba el intermediario de oxocarbenio y evitaba la sobreoxidación para dar exclusivamente 2S-hidroximutilina después de la hidrólisis de los grupos protectores de sililo.

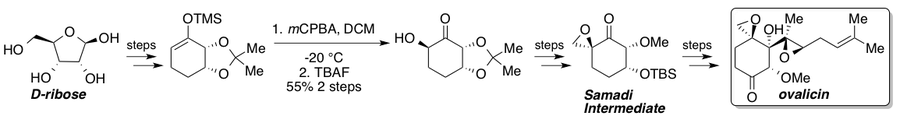
La ovalicina, la fumagilina y sus derivados exhiben fuertes propiedades antiangiogénicas y han visto numerosas síntesis totales desde su aislamiento. [35] Corey y Dittami informaron la primera síntesis total de ovalicina racémica en 1985 [36] seguida de dos síntesis asimétricas informadas en 1994 por Samadi [37] [38] y Corey [39] que presentaron una estrategia de grupo quiral a partir de L- quebrachitol y una dihidroxilación asimétrica, respectivamente. En 2010, Yadav y colaboradores informaron una ruta que interceptó la ruta Samadi desde el material de partida del grupo quiral D- ribosa . [40] Una oxidación estándar de Rubottom da un solo estereoisómero debido al control del sustrato y representa el paso estereogénico clave en la ruta a la cetona Samadi. Una vez sintetizada, la cetona Samadi podría elaborarse a (−)-ovalicina a través de pasos conocidos.
El velutinol A [41] fue sintetizado por primera vez por Isaka y colaboradores. [42] Los autores muestran que la alta regioselectividad de esta reacción está dirigida por el grupo hidroxilo syn al protón de fusión del anillo. Las reacciones en las que se invierte la estereoquímica del grupo hidroxilo mostraron una regioselectividad menor, y la eliminación del grupo hidroxilo dio lugar a la formación exclusiva del otro regioisómero. Es probable que la proximidad del grupo hidroxilo en el isómero syn acidifique el protón de fusión del anillo a través de interacciones de enlaces de hidrógeno, facilitando así la desprotonación regioselectiva por trietilamina. A continuación, el éter de enol de sililo se trató con un exceso de mCPBA para facilitar una oxidación “doble” de Rubottom para dar el producto exo con ambos grupos hidroxilo en el exterior del sistema de anillo fusionado. Este producto dihidroxi se transformó luego en velutinol A en tres pasos adicionales.

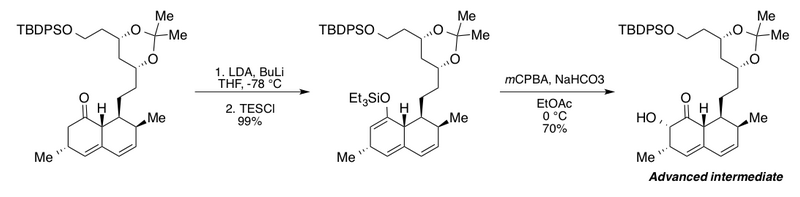
El grupo Clive utilizó la oxidación de Rubottom en la síntesis de un intermedio avanzado para sus estudios de degradación del metabolito fúngico reductor del colesterol mevinolina . [2] [43] Esta interesante secuencia presenta la adición de un exceso de n-butillitio (BuLi) en presencia de diisopropilamida de litio (LDA) para la conversión completa del derivado de cetona bicíclica al éter enólico de sililo correspondiente. Sin BuLi, los autores informan un rendimiento máximo de solo el 72%. Las condiciones posteriores de oxidación amortiguada de Rubottom con bicarbonato de sodio en acetato de etilo proporcionaron la α-hidroxicetona como un solo diastereómero.
El grupo Falk sintetizó varios derivados del fosfatidil-D-mioinositol para ayudar en el estudio de las diversas vías de señalización celular de la fosfatidilinositol 3-quinasa (PI3K). [2] [44] Su ruta hacia la recolección de análogos de sustrato explota una oxidación estereoselectiva controlada por sustrato de Rubottom utilizando dimetil dioxirano (DMDO) como oxidante y ácido canforsulfónico catalítico (CSA) para ayudar en la hidrólisis. Para grupos protectores, consulte la ref. [10]

Si bien la oxidación de Rubottom generalmente da buenos rendimientos y es altamente escalable (ver síntesis de 2S-hidroximutilina), aún existen algunos problemas con la reacción. Como se mencionó anteriormente, las condiciones de reacción ácidas no son toleradas por muchos sustratos complejos, pero esto se puede abrogar con el uso de sistemas tampón. [1] La mala economía de átomos también es un problema importante con la reacción porque requiere oxidante estequiométrico, que genera grandes cantidades de desechos. [3] Los peróxidos también pueden ser peligrosos para trabajar. Se sabe que el mCPBA detona por choque o chispas. [45]
Aunque los éteres de sililo enol de aldehídos y cetonas son los sustratos tradicionales para la oxidación de Rubottom, como se mencionó anteriormente, los acetales de sililo ceteno y los bis (acetales de sililo) se pueden oxidar a sus derivados de α-hidroxi éster o ácido carboxílico utilizando acetato de plomo (IV) o ácido hipofluoroso - acetonitrilo (HOF-ACN). [27] Sin embargo, estas α-hidroxilaciones no proceden a través de intermediarios de éter de sililo enol y, por lo tanto, técnicamente no son oxidaciones de Rubottom. Se pueden utilizar varios oxidantes para oxidar muchos de estos derivados de carbonilo después de que se convierten en su respectivo enolato o anión relacionado. Algunos oxidantes comunes son los peroxiácidos, el oxígeno molecular y los reactivos de yodo hipervalente. [5]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )