
En química analítica , una curva de calibración , también conocida como curva estándar , es un método general para determinar la concentración de una sustancia en una muestra desconocida comparando la desconocida con un conjunto de muestras estándar de concentración conocida. [1] Una curva de calibración es un enfoque para el problema de la calibración de instrumentos; otros enfoques estándar pueden mezclar el estándar con lo desconocido, dando un estándar interno . La curva de calibración es un gráfico de cómo la respuesta instrumental, la llamada señal analítica, cambia con la concentración del analito (la sustancia a medir).
En un uso más general, una curva de calibración es una curva o tabla para un instrumento de medición que mide algún parámetro indirectamente, dando valores para la cantidad deseada como una función de los valores de salida del sensor . Por ejemplo, se puede hacer una curva de calibración para un transductor de presión particular para determinar la presión aplicada a partir de la salida del transductor (un voltaje). [2] Dicha curva se usa típicamente cuando un instrumento utiliza un sensor cuya calibración varía de una muestra a otra, o cambia con el tiempo o el uso; si la salida del sensor es consistente, el instrumento se marcaría directamente en términos de la unidad medida.
El operador prepara una serie de estándares en un rango de concentraciones cercanas a la concentración esperada de analito en el elemento desconocido. Las concentraciones de los estándares deben estar dentro del rango de trabajo de la técnica (instrumentación) que están utilizando. [3] El análisis de cada uno de estos estándares utilizando la técnica elegida producirá una serie de mediciones. Para la mayoría de los análisis, un gráfico de la respuesta del instrumento frente a la concentración mostrará una relación lineal. El operador puede medir la respuesta del elemento desconocido y, utilizando la curva de calibración, puede interpolar para encontrar la concentración de analito.
Los datos (las concentraciones del analito y la respuesta del instrumento para cada estándar) se pueden ajustar a una línea recta mediante un análisis de regresión lineal . Esto produce un modelo descrito por la ecuación y = mx + y 0 , donde y es la respuesta del instrumento, m representa la sensibilidad e y 0 es una constante que describe el fondo. La concentración del analito ( x ) de muestras desconocidas se puede calcular a partir de esta ecuación.
Se pueden utilizar muchas variables diferentes como señal analítica. Por ejemplo, el cromo (III) se puede medir mediante un método de quimioluminiscencia , en un instrumento que contiene un tubo fotomultiplicador (PMT) como detector. El detector convierte la luz producida por la muestra en un voltaje, que aumenta con la intensidad de la luz. La cantidad de luz medida es la señal analítica.

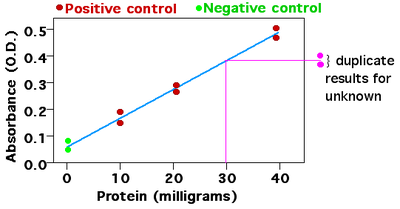
El ensayo de Bradford es un ensayo colorimétrico que mide la concentración de proteínas. El reactivo azul brillante de Coomassie se vuelve azul cuando se une a la arginina y a los aminoácidos aromáticos presentes en las proteínas, aumentando así la absorbancia de la muestra. La absorbancia se mide utilizando un espectrofotómetro , a la frecuencia máxima de absorbancia (Amax ) del colorante azul (que es de 595 nm). En este caso, cuanto mayor sea la absorbancia, mayor será la concentración de proteínas.
Los datos de concentraciones conocidas de proteína se utilizan para hacer la curva estándar, trazando la concentración en el eje X y la medición del ensayo en el eje Y. Luego se realiza el mismo ensayo con muestras de concentración desconocida. Para analizar los datos, se ubica la medición en el eje Y que corresponde a la medición del ensayo de la sustancia desconocida y se sigue una línea para intersecar la curva estándar. El valor correspondiente en el eje X es la concentración de la sustancia en la muestra desconocida. [4] [5]
Como era de esperar, la concentración de la incógnita tendrá algún error que se puede calcular a partir de la fórmula siguiente. [6] [7] [8] Esta fórmula supone que se observa una relación lineal para todos los estándares. Es importante señalar que el error en la concentración será mínimo si la señal de la incógnita se encuentra en el medio de las señales de todos los estándares (el término tiende a cero si )
La mayoría de las técnicas analíticas utilizan una curva de calibración. Este enfoque tiene varias ventajas. En primer lugar, la curva de calibración proporciona una forma fiable de calcular la incertidumbre de la concentración calculada a partir de la curva de calibración (utilizando las estadísticas de la línea de mínimos cuadrados ajustada a los datos). [9] [10]
En segundo lugar, la curva de calibración proporciona datos sobre una relación empírica. El mecanismo de respuesta del instrumento al analito se puede predecir o comprender según algún modelo teórico, pero la mayoría de estos modelos tienen un valor limitado para las muestras reales. (La respuesta del instrumento suele depender en gran medida de la condición del analito, los disolventes utilizados y las impurezas que pueda contener; también puede verse afectada por factores externos como la presión y la temperatura).
Muchas relaciones teóricas, como la fluorescencia , requieren de todos modos la determinación de una constante instrumental mediante el análisis de uno o más estándares de referencia; una curva de calibración es una extensión conveniente de este enfoque. La curva de calibración para un analito particular en una muestra (tipo de muestra) particular proporciona la relación empírica necesaria para esas mediciones particulares.
Las principales desventajas son (1) que los estándares requieren un suministro del material analito, preferiblemente de alta pureza y en concentración conocida, y (2) que los estándares y el material desconocido están en la misma matriz. Algunos analitos (por ejemplo, proteínas particulares) son extremadamente difíciles de obtener puros en cantidad suficiente. Otros analitos a menudo se encuentran en matrices complejas, por ejemplo, metales pesados en el agua del estanque. En este caso, la matriz puede interferir con o atenuar la señal del analito. Por lo tanto, no es posible una comparación entre los estándares (que no contienen compuestos que interfieran) y el material desconocido. El método de adición de estándares es una forma de manejar tal situación.