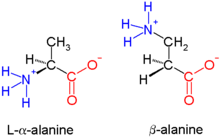
Los beta-péptidos ( β-péptidos ) son péptidos derivados de β-aminoácidos , en los que el grupo amino está unido al carbono β (es decir, el carbono a dos átomos del grupo carboxilato ). El β-aminoácido original es β-alanina (H 2 NCH 2 CH 2 CO 2 H), una sustancia natural común, pero la mayoría de los ejemplos presentan sustituyentes en lugar de uno o más enlaces CH. Los β-péptidos generalmente no ocurren en la naturaleza. Los antibióticos basados en β-péptidos se están explorando como formas de evadir la resistencia a los antibióticos . [1] Los primeros estudios en este campo fueron publicados en 1996 por el grupo de Dieter Seebach [1] y el de Samuel Gellman. [2]
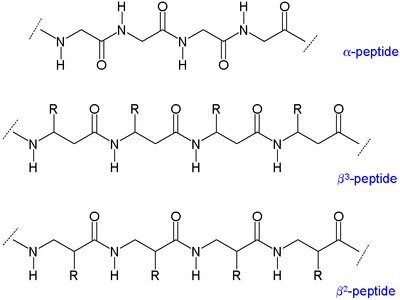
Como hay dos carbonos disponibles para la sustitución, los β-aminoácidos tienen cuatro sitios (quiralidad incluida; a diferencia de los dos de los α-aminoácidos) para unir el grupo de residuos orgánicos. [3] En consecuencia, existen dos tipos principales de β-aminoácidos que se diferencian por el carbono al que está unido el residuo: los que tienen el residuo orgánico (R) junto a la amina se denominan β 3 y los que tienen la posición junto al grupo carbonilo se denominan β 2 . Un β-péptido puede consistir en un solo tipo de estos aminoácidos (β 2 -péptidos y β 3 -péptidos), o tener una combinación de los dos. Además, un β-aminoácido puede formar un anillo utilizando ambos sitios y también incorporarse a un péptido. [3]
Los β-aminoácidos se han preparado mediante muchas rutas, [4] [5] incluidas algunas basadas en la síntesis de Arndt-Eistert .
Debido a que sus cadenas principales son más largas que las de los péptidos normales, los péptidos β forman estructuras secundarias dispares . Los sustituyentes de alquilo en las posiciones α y β en un β-aminoácido favorecen una conformación gauche en relación con el enlace entre el carbono α y el carbono β. Esto también afecta la estabilidad termodinámica de la estructura.
Se han descrito muchos tipos de estructuras helicoidales formadas por péptidos β. Estos tipos de conformación se distinguen por la cantidad de átomos en el anillo unido por enlaces de hidrógeno que se forma en solución; se han descrito 8-hélices, 10-hélices, 12-hélices, 14-hélices [6] y 10/12-hélices. En términos generales, los péptidos β forman una hélice más estable que los péptidos α. [7]
Los β-péptidos son estables frente a la degradación proteolítica in vitro e in vivo , una ventaja potencial sobre los péptidos naturales. [8] Los β-péptidos se han utilizado para imitar antibióticos naturales basados en péptidos como las magaininas , que son muy potentes pero difíciles de usar como fármacos porque son degradados por enzimas proteolíticas. [9]
Existen β-aminoácidos con una amplia variedad de sustituyentes. Nombrados por analogía a los α-aminoácidos biológicos , los siguientes se han encontrado de forma natural: β-alanina, β-leucina , β-lisina , β-arginina, β-glutamato, β-glutamina, β-fenilalanina y β-tirosina. [10] : 23 De estos, la β-alanina se encuentra en mamíferos y se incorpora en el ácido pantoténico , un nutriente esencial. [10] : 2 Dos α-aminoácidos también son estructuralmente β-aminoácidos: ácido aspártico y asparagina . [10] : 218 Las microcistinas son una clase de compuestos que contienen un residuo β-isoaspartilo (es decir, ácido aspártico unido con su beta-carboxilo). [10] : 23