Un material superduro es un material con un valor de dureza superior a 40 gigapascales ( GPa ) cuando se mide mediante la prueba de dureza Vickers . [1] [2] [3] [4] Son sólidos prácticamente incompresibles con alta densidad electrónica y alta covalencia de enlace . Como resultado de sus propiedades únicas, estos materiales son de gran interés en muchas áreas industriales que incluyen, entre otras, abrasivos , herramientas de pulido y corte , frenos de disco y recubrimientos protectores y resistentes al desgaste .
El diamante es el material más duro conocido hasta la fecha, con una dureza Vickers en el rango de 70-150 GPa. El diamante demuestra tanto una alta conductividad térmica como propiedades de aislamiento eléctrico , y se ha puesto mucha atención en encontrar aplicaciones prácticas de este material. Sin embargo, el diamante tiene varias limitaciones para la aplicación industrial masiva, incluido su alto costo y oxidación a temperaturas superiores a 800 °C. [5] [6] [7] Además, el diamante se disuelve en hierro y forma carburos de hierro a altas temperaturas y, por lo tanto, es ineficiente en el corte de materiales ferrosos, incluido el acero . Por lo tanto, la investigación reciente de materiales superduros se ha centrado en compuestos que serían térmica y químicamente más estables que el diamante puro.
La búsqueda de nuevos materiales superduros generalmente ha tomado dos caminos. [8] En el primer enfoque, los investigadores emulan los enlaces de carbono covalentes direccionales cortos del diamante combinando elementos ligeros como boro, carbono, nitrógeno y oxígeno. Este enfoque se hizo popular a fines de la década de 1980 con la exploración de compuestos ternarios C 3 N 4 y BCN. El segundo enfoque hacia el diseño de materiales superduros incorpora estos elementos más ligeros (B, C, N y O), pero también introduce metales de transición con altas densidades de electrones de valencia para proporcionar alta incompresibilidad. De esta manera, los metales con altos módulos de volumen pero baja dureza se coordinan con pequeños átomos formadores de covalentes para producir materiales superduros. El carburo de tungsteno es una manifestación industrialmente relevante de este enfoque, aunque no se considera superduro. Alternativamente, los boruros combinados con metales de transición se han convertido en un área rica de investigación superdura y han llevado a descubrimientos como ReB 2 , OsB 2 y WB 4 .
Los materiales superduros se pueden clasificar generalmente en dos categorías: compuestos intrínsecos y compuestos extrínsecos. El grupo intrínseco incluye el diamante , el nitruro de boro cúbico (c-BN), los nitruros de carbono y los compuestos ternarios como el BNC, que poseen una dureza innata. Por el contrario, los materiales extrínsecos son aquellos que tienen superdureza y otras propiedades mecánicas que están determinadas por su microestructura en lugar de su composición. [9] [10] [11] Un ejemplo de material superduro extrínseco es el diamante nanocristalino conocido como nanobarras de diamante agregadas .


La dureza de un material está directamente relacionada con su incompresibilidad, elasticidad y resistencia al cambio de forma. Un material superduro tiene un módulo de corte alto, un módulo volumétrico alto y no se deforma plásticamente . Idealmente, los materiales superduros deberían tener una red isotrópica libre de defectos. Esto reduce en gran medida las deformaciones estructurales que pueden reducir la resistencia del material. Sin embargo, los defectos pueden realmente fortalecer algunas estructuras covalentes. Tradicionalmente, se han utilizado condiciones de alta presión y alta temperatura ( HPHT ) para sintetizar materiales superduros, pero las síntesis recientes de materiales superduros apuntan a utilizar menos energía y materiales de menor costo. [10] [11]
Históricamente, la dureza se definió primero como la capacidad de un material para rayar a otro y se cuantificó mediante un número entero (a veces medio entero) de 0 a 10 en la escala de Mohs . Sin embargo, rápidamente se descubrió que esta escala era demasiado discreta y no lineal. La medición de la dureza mecánica de los materiales cambió al uso de un nanoindentador (generalmente hecho de diamante) y la evaluación de los módulos volumétricos, y se desarrollaron las escalas Brinell , Rockwell , Knoop y Vickers . Si bien la escala Vickers es ampliamente aceptada como una prueba más común, [11] siguen existiendo controversias sobre la carga de peso que se debe aplicar durante la prueba. Esto se debe a que los valores de dureza Vickers dependen de la carga. Una indentación hecha con 0,5 N indicará un valor de dureza más alto que una indentación hecha con 50 N. Este fenómeno se conoce como efecto del tamaño de la indentación (ISE). Por lo tanto, los valores de dureza no son significativos a menos que también se informe la carga. Algunos sostienen que los valores de dureza deberían informarse consistentemente en la región asintótica (región de alta carga), ya que esta es una representación más estandarizada de la dureza de un material. [12]
Los módulos volumétricos, los módulos de corte y la elasticidad son los factores clave en el proceso de clasificación de superduros. La incompresibilidad de un material se cuantifica mediante el módulo volumétrico B, que mide la resistencia de un sólido a la compresión de volumen bajo tensión hidrostática como B = −Vdp/dV. Aquí V es el volumen, p es la presión y dp/dV es la derivada parcial de la presión con respecto al volumen. La prueba del módulo volumétrico utiliza una herramienta de penetración para formar una deformación permanente [ dudoso – discutir ] en un material. [ cita requerida ] El tamaño de la deformación depende de la resistencia del material a la compresión de volumen realizada por la herramienta. Los elementos con volúmenes molares pequeños y fuertes fuerzas interatómicas suelen tener módulos volumétricos altos. Los módulos volumétricos fueron la primera prueba importante de dureza y originalmente se demostró que estaban correlacionados con el volumen molar (V m ) y la energía cohesiva (E c ) como B ~ E c /V m .
Se creía que el módulo volumétrico era una medida directa de la dureza de un material, pero esta ya no es la escuela de pensamiento dominante. Por ejemplo, algunos metales alcalinos y nobles (Pd, Ag) tienen una relación anómalamente alta entre el módulo volumétrico y la dureza Vickers o Brinell. A principios de la década de 2000, se encontró una relación directa entre el módulo volumétrico y la densidad de electrones de valencia, ya que cuanto más electrones había presentes, mayores eran las repulsiones dentro de la estructura. [10] El módulo volumétrico todavía se utiliza como una medida preliminar de un material como superduro, pero ahora se sabe que se deben tener en cuenta otras propiedades. [10] [11]
A diferencia del módulo volumétrico, el módulo de corte mide la resistencia al cambio de forma a un volumen constante, teniendo en cuenta el plano cristalino y la dirección del corte. El módulo de corte G se define como la relación entre la tensión de corte y la deformación de corte: G = tensión/deformación = F·L/(A·dx), donde F es la fuerza aplicada, A es el área sobre la que actúa la fuerza, dx es el desplazamiento resultante y L es la longitud inicial. Cuanto mayor sea el módulo de corte, mayor será la capacidad de un material para resistir fuerzas de corte. Por lo tanto, el módulo de corte es una medida de rigidez. El módulo de corte está relacionado con el módulo volumétrico como 3/G = 2B(1 − 2v)(1 + v) , donde v es el coeficiente de Poisson, que normalmente es ~0,1 en materiales covalentes. Si un material contiene enlaces altamente direccionales, el módulo de corte aumentará y dará un coeficiente de Poisson bajo.
Un material también se considera duro si resiste la deformación plástica . Si un material tiene enlaces covalentes cortos, es menos probable que se produzcan dislocaciones atómicas que conduzcan a la deformación plástica que en materiales con enlaces más largos y deslocalizados. Si un material contiene muchos enlaces deslocalizados, es probable que sea blando. [10] Algo relacionada con la dureza es otra propiedad mecánica , la tenacidad a la fractura , que es la capacidad de un material para resistir la rotura por un impacto fuerte (nótese que este concepto es distinto de la noción de tenacidad ). Un material superduro no es necesariamente "superresistente". Por ejemplo, la tenacidad a la fractura del diamante es de aproximadamente 7–10 MPa ·m 1/2 , [16] [17] que es alta en comparación con otras piedras preciosas y materiales cerámicos, pero pobre en comparación con muchos metales y aleaciones: los aceros comunes y las aleaciones de aluminio tienen valores de tenacidad al menos 5 veces más altos. [18]
Se deben tener en cuenta varias propiedades al evaluar un material como (super)duro. Si bien los materiales duros tienen módulos volumétricos altos, un módulo volumétrico alto no significa que un material sea duro. También se deben considerar las características inelásticas, y el módulo de corte puede incluso proporcionar una mejor correlación con la dureza que el módulo volumétrico. Los materiales covalentes generalmente tienen constantes de fuerza de flexión de enlace altas y módulos de corte altos y es más probable que den estructuras superduras que, por ejemplo, los sólidos iónicos. [10] [11]

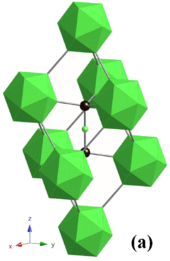
El diamante es un alótropo del carbono en el que los átomos están dispuestos en una versión modificada de la estructura cúbica centrada en las caras ( fcc ), conocida como " diamante cúbico ". Es conocido por su dureza (véase la tabla anterior) e incompresibilidad y está destinado a algunas posibles aplicaciones ópticas y eléctricas. Las propiedades de los diamantes naturales individuales o carbonatados varían demasiado para fines industriales y, por lo tanto, el diamante sintético se convirtió en un importante foco de investigación. [19] [20]
La síntesis de diamante a alta presión en 1953 en Suecia [21] [22] y en 1954 en los EE. UU. [23], que fue posible gracias al desarrollo de nuevos aparatos y técnicas, se convirtió en un hito en la síntesis de materiales superduros artificiales. La síntesis mostró claramente el potencial de las aplicaciones de alta presión para fines industriales y estimuló un creciente interés en el campo. Cuatro años después de la primera síntesis de diamante artificial, se obtuvo nitruro de boro cúbico c-BN y se descubrió que era el segundo sólido más duro. [24]
El diamante sintético puede existir como un único cristal continuo o como pequeños policristales interconectados a través de los límites de los granos. La separación espacial inherente de estas subunidades provoca la formación de granos, que son visibles a simple vista debido a las propiedades de absorción y dispersión de la luz del material. [25]
La dureza del diamante sintético (70–150 GPa) depende en gran medida de la pureza relativa del propio cristal. Cuanto más perfecta sea la estructura cristalina, más duro será el diamante. Se ha informado de que los monocristales HPHT y los agregados de diamante nanocristalino ( nanobarras de diamante agregadas ) pueden ser más duros que el diamante natural. [25]
Históricamente, se pensaba que el diamante sintético debía ser estructuralmente perfecto para ser útil. Esto se debe a que el diamante se prefería principalmente por sus cualidades estéticas, y los pequeños defectos en la estructura y la composición eran visibles a simple vista. Si bien esto es cierto, las propiedades asociadas con estos pequeños cambios han llevado a nuevas aplicaciones potenciales interesantes del diamante sintético. Por ejemplo, el dopaje con nitrógeno puede mejorar la resistencia mecánica del diamante [26] , y el dopaje pesado con boro (varios porcentajes atómicos) lo convierte en un superconductor [27] .
En 2014, los investigadores informaron sobre la síntesis de diamantes nanomaclados [ aclaración necesaria ] con valores de dureza Vickers de hasta 200 GPa. [28] Los autores atribuyen la dureza sin precedentes al efecto Hall-Petch, que predice que las características microestructurales más pequeñas pueden conducir a una mayor dureza debido a una mayor densidad de límites que detienen las dislocaciones. Consiguen maclas con un espesor medio de 5 nm utilizando un precursor de nanopartículas de carbono de cebolla [ aclaración necesaria ] sometidas a alta temperatura y presión. También consiguen simultáneamente una temperatura de oxidación que es 200 °C superior a la del diamante natural. Una mayor estabilidad térmica es relevante para aplicaciones industriales como herramientas de corte, donde las altas temperaturas pueden provocar una rápida degradación del diamante.
Una forma densa AM-III de carbono amorfo transparente tiene una dureza Vickers de 113 GPa. [29] Este fulereno tratado térmicamente es actualmente el material amorfo más duro.
El nitruro de boro cúbico o c-BN fue sintetizado por primera vez en 1957 por Robert H. Wentorf en General Electric, poco después de la síntesis del diamante. [24] El proceso general para la síntesis de c-BN es la disolución de nitruro de boro hexagonal (h-BN) en un disolvente-catalizador, normalmente metales alcalinos o alcalinotérreos o sus nitruros , seguido de la nucleación espontánea de c-BN en condiciones de alta presión y alta temperatura (HPHT). [11] El rendimiento de c-BN es menor y sustancialmente más lento en comparación con la ruta sintética del diamante debido a los complicados pasos intermedios. Su insolubilidad en hierro y otras aleaciones metálicas lo hace más útil para algunas aplicaciones industriales que el diamante. [30]

El nitruro de boro cúbico puro es transparente o ligeramente ámbar. Se pueden producir diferentes colores dependiendo de los defectos o de un exceso de boro (menos del 1%). [11] Se pueden producir defectos dopando catalizadores de disolventes (es decir, nitruros de Li, Ca o Mg) con Al, B, Ti o Si. Esto induce un cambio en la morfología y el color de los cristales de c-BN. [31] El resultado son cristales más oscuros y más grandes (500 μm) con mejores formas y un mayor rendimiento.
El nitruro de boro cúbico adopta una estructura cristalina de esfalrita , que se puede construir reemplazando cada dos átomos de carbono en el diamante con un átomo de boro y un átomo de nitrógeno. El enlace BN corto (1,57 Å) es cercano a la longitud del enlace CC del diamante (1,54 Å), lo que da como resultado un fuerte enlace covalente entre átomos de la misma manera que en el diamante. La ligera disminución en la covalencia para los enlaces BN en comparación con los enlaces CC reduce la dureza de ~100 GPa para el diamante hasta 48 GPa en c-BN. Como el diamante es menos estable que el grafito, el c-BN es menos estable que el h-BN, pero la tasa de conversión entre esas formas es insignificante a temperatura ambiente. [30]
El nitruro de boro cúbico es insoluble en hierro, níquel y aleaciones relacionadas a altas temperaturas, pero se une bien con los metales debido a la formación de capas intermedias de boruros y nitruros metálicos. También es insoluble en la mayoría de los ácidos, pero es soluble en sales fundidas alcalinas y nitruros, como LiOH, KOH, NaOH/Na2CO3 , NaNO3 , que se utilizan para grabar c-BN. [ 32] Debido a su estabilidad con el calor y los metales, el c-BN supera al diamante en aplicaciones mecánicas. La conductividad térmica del BN está entre las más altas de todos los aislantes eléctricos. Además, el c-BN consta solo de elementos ligeros y tiene una baja capacidad de absorción de rayos X, capaz de reducir el fondo de absorción de rayos X. [33]
Debido a su gran robustez química y mecánica, el c-BN tiene una amplia aplicación como abrasivo, como en herramientas de corte y superficies resistentes a los arañazos. El nitruro de boro cúbico también es muy transparente a los rayos X. Esto, junto con su alta resistencia, hace posible tener recubrimientos muy delgados de c-BN en estructuras que pueden inspeccionarse mediante rayos X. Cada año se producen varios cientos de toneladas de c-BN en todo el mundo. [34] Por modificación, Borazon, una marca estadounidense de c-BN, se utiliza en aplicaciones industriales para dar forma a las herramientas, ya que puede soportar temperaturas superiores a los 2000 °C. Las muelas abrasivas recubiertas de nitruro de boro cúbico, denominadas ruedas Borazon, se utilizan rutinariamente en el mecanizado de metales ferrosos duros, hierros fundidos y superaleaciones a base de níquel y cobalto . Otras marcas, como Elbor y Cubonite, son comercializadas por vendedores rusos. [30]
Los nuevos enfoques en la investigación se centran en mejorar las capacidades de presión de c-BN de los dispositivos utilizados para la síntesis de c-BN. [11] En la actualidad, las capacidades para la producción de c-BN están restringidas a presiones de aproximadamente 6 GPa. Aumentar el límite de presión permitirá la síntesis de monocristales más grandes que los de la síntesis catalítica actual. Sin embargo, se ha demostrado que el uso de disolventes en condiciones supercríticas para la síntesis de c-BN reduce los requisitos de presión. [11] El alto costo del c-BN aún limita su aplicación, lo que motiva la búsqueda de otros materiales superduros.
La estructura del nitruro de carbono beta (β-C 3 N 4 ) fue propuesta por primera vez por Amy Liu y Marvin Cohen en 1989. Es isoestructural con Si 3 N 4 y se predijo que sería más duro que el diamante. [35] La longitud de enlace calculada fue de 1,47 Å, un 5 % más corta que la longitud de enlace CC en el diamante. Cálculos posteriores indicaron que el módulo de corte es el 60 % del del diamante, y el nitruro de carbono es menos duro que el c-BN. [36]
A pesar de dos décadas de búsqueda de este compuesto, ninguna muestra sintética de C 3 N 4 ha validado las predicciones de dureza; esto se ha atribuido a la dificultad de la síntesis y la inestabilidad del C 3 N 4 . El nitruro de carbono solo es estable a una presión que es más alta que la de la transformación de grafito a diamante. Las condiciones de síntesis requerirían presiones extremadamente altas porque el carbono está coordinado cuatro y seis veces. [11] Además, el C 3 N 4 plantearía problemas de formación de carburo si se usara para mecanizar metales ferrosos. Aunque las publicaciones han informado sobre la preparación de C 3 N 4 a presiones más bajas que las indicadas, no se demostró que el C 3 N 4 sintético sea superduro. [37]
Los tamaños atómicos similares del boro, el carbono y el nitrógeno, así como las estructuras similares de los polimorfos de carbono y nitruro de boro, sugieren que podría ser posible sintetizar una fase similar al diamante que contenga los tres elementos. También es posible fabricar compuestos que contengan BCO, BON o BCON a alta presión, pero su síntesis requeriría una química compleja y, además, sus propiedades elásticas serían inferiores a las del diamante.
A partir de 1990, se ha puesto un gran interés en estudiar la posibilidad de sintetizar fases densas de BCN. Se espera que sean térmica y químicamente más estables que el diamante y más duras que el c-BN, y por lo tanto serían materiales excelentes para el corte y pulido a alta velocidad de aleaciones ferrosas. Estas propiedades características se atribuyen a la estructura similar al diamante combinada con los enlaces σ sp3 entre el carbono y los heteroátomos. Las películas delgadas de BC x N y se sintetizaron por deposición química de vapor en 1972. [38] Sin embargo, los datos sobre el intento de síntesis de fases densas de BCN informados por diferentes autores han sido contradictorios. No está claro si los productos de síntesis son soluciones sólidas similares al diamante entre el carbono y el nitruro de boro o simplemente mezclas mecánicas de diamante y c-BN altamente dispersos. En 2001, se sintetizó un c-BC 2 N con estructura similar al diamante a presiones >18 GPa y temperaturas >2200 K mediante una transición de fase de estado sólido directa de grafito (BN) 0,48 C 0,52 . Las durezas Vickers y Knoop informadas fueron intermedias entre el diamante y el c-BN, lo que convierte a la nueva fase en el segundo material más duro conocido. [39] Las fases ternarias B–C–N también se pueden hacer utilizando síntesis de compresión por choque. Además, se sugirió extender el sistema B–C–N a compuestos cuaternarios con silicio incluido. [9] [40]
A diferencia de los sistemas basados en carbono, los boruros metálicos se pueden sintetizar fácilmente en grandes cantidades en condiciones ambientales, una ventaja tecnológica importante. [10] La mayoría de los boruros metálicos son duros; [41] sin embargo, algunos se destacan entre ellos por sus durezas particularmente altas (por ejemplo, WB 4 , [42] [43] RuB 2 , OsB 2 y ReB 2 ). Estos boruros metálicos siguen siendo metales y no semiconductores o aislantes (como lo indica su alta densidad electrónica de estados en el nivel de Fermi ); sin embargo, el enlace covalente adicional BB y MB (M = metal) conduce a una alta dureza. [44] [45] Los metales pesados densos , como el osmio , el renio , el tungsteno , etc., son particularmente aptos para formar boruros duros debido a sus altas densidades electrónicas, pequeños radios atómicos, altos módulos volumétricos y capacidad para unirse fuertemente con el boro.

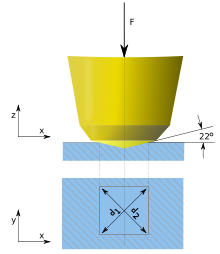
El diboruro de osmio (OsB 2 ) tiene un módulo volumétrico alto de 395 GPa y, por lo tanto, se considera un material superduro candidato, pero la dureza Vickers máxima alcanzada es de 37 GPa, ligeramente por debajo del límite de 40 GPa de superdureza. Una forma común de sintetizar OsB 2 es mediante una reacción de metátesis en estado sólido que contiene una mezcla 2:3 de OsCl 3 : MgB 2 . [10] Después de que el producto MgCl 2 se elimina por lavado, la difracción de rayos X indica productos de OsB 2 , OsB y Os. Calentar este producto a 1000 °C durante tres días produce un producto cristalino puro de OsB 2 . OsB 2 tiene una estructura ortorrómbica ( grupo espacial P mmn ) con dos planos de átomos de osmio separados por una capa no plana de átomos de boro coordinados hexagonalmente; Los parámetros de red son a = 4,684 Å, b = 2,872 Å y c = 4,096 Å. [10] La dirección b del cristal es la más compresible y la dirección c es la menos compresible. [46] Esto se puede explicar por la estructura ortorrómbica. Al observar los átomos de boro y osmio en las direcciones a y b , están dispuestos de manera que están desplazados entre sí. Por lo tanto, cuando se comprimen, no se empujan uno contra el otro. La repulsión electrostática es la fuerza que maximiza la incompresibilidad de los materiales y, por lo tanto, en este caso, la repulsión electrostática no se aprovecha al máximo. Cuando se comprime en la dirección c , los átomos de osmio y boro están casi directamente alineados entre sí y, por lo tanto, la repulsión electrostática es alta, lo que hace que la dirección c sea la menos compresible. Este modelo implica que si el boro se distribuye de manera más uniforme a lo largo de la red, la incompresibilidad podría ser mayor. La difracción de retrodispersión de electrones acoplada a las mediciones de dureza revela que en el plano (010), el cristal es un 54 % más duro en la dirección <100> que en la dirección <001>. Esto se puede ver observando la longitud de la indentación a lo largo de una determinada dirección (relacionada con las indentaciones realizadas con una prueba de dureza Vickers). Junto con la alineación de los átomos, esto también se debe a los enlaces covalentes BB cortos (1,80 Å) en la dirección <100>, que están ausentes en la dirección <001> (BB = 4,10 Å). [10]
El renio fue considerado un candidato para boruros de metales superduros debido a sus características físicas y químicas deseables. Tiene una alta densidad electrónica, un radio atómico pequeño y un alto módulo volumétrico. Cuando se combina con boro, forma un cristal con un enlace altamente covalente que le permite ser incompresible y potencialmente muy duro. [47] Se ha investigado una amplia gama de boruros de renio, incluidos Re 3 B, Re 7 B 3 , Re 2 B, ReB, Re 2 B 3 , Re 3 B 7 , Re 2 B 5 , ReB 3 y ReB 2 . Cada uno de estos materiales tiene su propio conjunto de propiedades y características. Algunos se muestran prometedores como superconductores y algunos tienen propiedades elásticas y electrónicas únicas, pero el más relevante para los materiales superduros es ReB 2 . [47]
El diboruro de renio (ReB 2 ) es un compuesto refractario que se sintetizó por primera vez en la década de 1960, utilizando hornos de fusión por arco , de fusión por zonas o de zona flotante óptica. Un ejemplo de síntesis de este material es el método de fundente, que se lleva a cabo colocando renio metálico y boro amorfo en un crisol de alúmina con exceso de aluminio. Esto se puede realizar con una proporción de 1:2:50 para Re:B:Al, con el exceso de aluminio como medio de crecimiento. El crisol se coloca en un tubo de alúmina, se inserta en un horno calentado por resistencia con gas argón fluyendo y se sinteriza a 1400 °C durante varias horas. Después de enfriar, el aluminio se disuelve en NaOH. Cada ruta de síntesis de ReB 2 tiene sus propios inconvenientes, y esta da pequeñas inclusiones de aluminio incorporadas en la red cristalina. [48]
El diboruro de renio tiene un punto de fusión muy alto, cercano a los 2400 °C, y una estructura cristalina en capas altamente anisotrópica. [48] Su simetría es hexagonal (grupo espacial P6 3 mc ) u ortorrómbica (C mcm ) dependiendo de la fase. Allí, las capas de Re muy compactas se alternan con capas de boro triangulares fruncidas a lo largo del plano (001). Esto se puede ver arriba en el ejemplo del diboruro de osmio. La densidad de estados para ReB 2 tiene uno de los valores más bajos entre los boruros metálicos, lo que indica un fuerte enlace covalente y una alta dureza. [47]
Debido a la naturaleza anisotrópica de este material, la dureza depende de la orientación del cristal. El plano (002) contiene el carácter más covalente y exhibe un valor máximo de dureza Vickers de 40,5 GPa, mientras que los planos perpendiculares fueron un 6% más bajos a 38,1 GPa. Estos valores disminuyen con el aumento de la carga, estableciéndose en alrededor de 28 GPa cada uno. Se encontró que los valores de nanoindentación fueron 36,4 GPa y 34,0 GPa para los planos (002) y perpendicular respectivamente. Los valores de dureza dependen de la pureza y composición del material (cuanto más boro, más duro es el boruro) y los valores anteriores son para una relación Re:B de aproximadamente 1,00:1,85. El diboruro de renio también tiene un módulo volumétrico informado de 383 GPa y un módulo de corte de 273 GPa. [48] [49] La dureza del diboruro de renio y la mayoría de los demás materiales también depende de la carga durante la prueba. Los valores anteriores de aproximadamente 40 GPa se midieron con una carga efectiva de 0,5 a 1 N. Con una carga tan baja, los valores de dureza también se sobreestiman para otros materiales; por ejemplo, supera los 100 GPa para c-BN. [4] Otros investigadores, si bien han reproducido la alta dureza de ReB 2 con una carga baja, informaron valores mucho más bajos de 19 a 17 GPa con una carga más convencional de 3 a 49 N, lo que hace que ReB 2 sea un material duro, pero no superduro. [4] [14] [50]
El diboruro de renio exhibe una conductividad metálica que aumenta a medida que disminuye la temperatura y puede explicarse por una densidad de estados distinta de cero debido a la superposición de d y p del renio y el boro respectivamente. En este punto, es el único material superduro con comportamiento metálico. El material también exhibe una estabilidad térmica relativamente alta. Dependiendo del método de calentamiento, mantendrá su masa hasta temperaturas de 600–800 °C, y cualquier caída se debe a la pérdida de agua absorbida. Luego, se puede ver una pequeña pérdida de masa a temperaturas cercanas a los 1000 °C. Funciona mejor cuando se utiliza una rampa de calor más lenta. Parte de esta pequeña caída alrededor de los 1000 °C se explicó por la formación de una capa opaca de B2O3 en la superficie a medida que el boro se lixivia del sólido, que sirve como capa protectora, reduciendo así la pérdida adicional de boro. Esto se puede disolver fácilmente con metanol para restaurar el material a su estado brillante nativo. [48] [49] [51]
El descubrimiento del tetraboruro de tungsteno superduro es una prueba más del prometedor enfoque de diseño de unión covalente de metales de transición incompresibles con boro. Si bien el WB 4 se sintetizó e identificó por primera vez como el boruro de tungsteno de mayor calidad en 1966, [52] recién se lo reconoció como un material superduro económico en 2011. [53]
Curiosamente, los boruros de tungsteno de menor contenido, como el diboruro de tungsteno, no son superduros. Un mayor contenido de boro conduce a una mayor dureza debido a la mayor densidad de enlaces cortos covalentes boro-boro y boro-metal. Sin embargo, los investigadores han podido empujar al WB 2 al régimen superduro mediante adiciones minoritarias de otros metales de transición como el niobio y el tántalo en la estructura cristalina. [54] Este mecanismo de mejora de la dureza se denomina fortalecimiento de la solución sólida y surge porque se incorporan átomos de diferentes tamaños a la red original para impedir el movimiento de dislocación.
El boruro de aluminio y magnesio o BAM es un compuesto químico de aluminio , magnesio y boro . Si bien su fórmula nominal es AlMgB 14 , la composición química es más cercana a Al 0,75 Mg 0,75 B 14 . Es una aleación cerámica que es muy resistente al desgaste y tiene un bajo coeficiente de fricción por deslizamiento.

Otros compuestos duros ricos en boro incluyen B 4 C y B 6 O. El aB 4 C amorfo tiene una dureza de aproximadamente 50 GPa, que está en el rango de superdureza. [55] Puede verse como si estuviera formado por cristales similares a icosaedros de boro incrustados en un medio amorfo. Sin embargo, al estudiar la forma cristalina de B 4 C, la dureza es de solo unos 30 GPa. Esta forma cristalina tiene la misma estequiometría que B 13 C 3 , que consiste en icosaedros de boro conectados por átomos de boro y carbono. [55] El subóxido de boro (B 6 O) tiene una dureza de aproximadamente 35 GPa. Su estructura contiene ocho unidades de icosaedros de B 12 , que se encuentran en los vértices de una celda unitaria romboédrica. Hay dos átomos de oxígeno ubicados a lo largo de la dirección romboédrica (111). [56]
Los materiales nanosuperduros entran en la categoría extrínseca de materiales superduros. Debido a que los defectos moleculares afectan las propiedades superduras de los materiales a granel, es obvio que la microestructura de los materiales superduros les otorga sus propiedades únicas. El enfoque en la síntesis de materiales nanosuperduros se centra en minimizar las microfisuras que se producen dentro de la estructura mediante el endurecimiento de los límites de grano. La eliminación de las microfisuras puede fortalecer el material de 3 a 7 veces su resistencia original. El fortalecimiento de los límites de grano se describe mediante la ecuación de Hall-Petch [57].
Aquí σ c es la tensión de fractura crítica, d el tamaño del cristalito y σ 0 y k gb son constantes.
Si un material es frágil su resistencia depende principalmente de su resistencia a la formación de microfisuras. La tensión crítica que provoca el crecimiento de una microfisura de tamaño a 0 se da mediante una fórmula general [57]
Aquí E es el módulo de Young , k crack es una constante que depende de la naturaleza y la forma de la microfisura y de la tensión aplicada y γ s la energía cohesiva de la superficie.
La dureza media de un material disminuye con d (tamaño de cristalito) disminuyendo por debajo de 10 nm. Se han propuesto muchos mecanismos para el deslizamiento del límite de grano y, por lo tanto, el ablandamiento del material, pero aún no se comprenden los detalles. Además del fortalecimiento del límite de grano, se ha prestado mucha atención a la construcción de microheteroestructuras o nanoestructuras de dos materiales con diferencias muy grandes en los módulos elásticos. Las heteroestructuras se propusieron por primera vez en 1970 y contenían capas delgadas tan altamente ordenadas que teóricamente no podían separarse por medios mecánicos. Se creía que estas heteroestructuras altamente ordenadas eran más fuertes que las mezclas simples. Esta teoría se confirmó con las estructuras Al/Cu y Al/Ag. Después de la formación de Al/Cu y Al/Ag, la investigación se extendió a sistemas multicapa que incluían Cu/Ni, TiN/VN, W/WN, Hf/HfN y más. En todos los casos, la disminución del período reticular aumentó la dureza. [9] Una forma común de un material nanoestructurado son las nanobarras de diamante agregadas , que son más duras que el diamante a granel y actualmente son el material más duro (~150 GPa) conocido. [58]
{{cite journal}}: CS1 maint: URL no apta ( enlace )