La iónica de estado sólido es el estudio de conductores mixtos iónico-electrónicos y conductores totalmente iónicos ( electrolitos sólidos ) y sus usos. Algunos materiales que entran en esta categoría incluyen sólidos inorgánicos cristalinos y policristalinos, cerámicas, vidrios, polímeros y compuestos. Los dispositivos iónicos de estado sólido, como las pilas de combustible de óxido sólido , pueden ser mucho más fiables y duraderos, especialmente en condiciones adversas, que dispositivos comparables con electrolitos fluidos. [1]
El campo de la iónica de estado sólido se desarrolló por primera vez en Europa, comenzando con el trabajo de Michael Faraday sobre electrolitos sólidos Ag 2 S y PbF 2 en 1834. Posteriormente Walther Nernst realizó contribuciones fundamentales , quien derivó la ecuación de Nernst y detectó la conducción iónica. en circonio dopado heterovalentemente , que aplicó en su lámpara Nernst . Otro gran paso adelante fue la caracterización del yoduro de plata en 1914. Alrededor de 1930, Yakov Frenkel , Walter Schottky y Carl Wagner establecieron el concepto de defectos puntuales , incluido el desarrollo de la termodinámica de defectos puntuales por parte de Schottky y Wagner; esto ayudó a explicar el transporte iónico y electrónico en cristales iónicos, vidrios conductores de iones, electrolitos poliméricos y nanocompuestos. A finales del siglo XX y principios del XXI, los iónicos de estado sólido se centraron en la síntesis y caracterización de nuevos electrolitos sólidos y sus aplicaciones en sistemas de baterías de estado sólido, pilas de combustible y sensores. [2]
El término iónico en estado sólido fue acuñado en 1967 por Takehiko Takahashi, [3] pero no se utilizó ampliamente hasta la década de 1980, con la aparición de la revista Solid State Ionics . La primera conferencia internacional sobre este tema se celebró en 1972 en Belgirate , Italia, bajo el nombre "Transporte Rápido de Iones en Sólidos, Baterías y Dispositivos de Estado Sólido". [2]

A principios de la década de 1830, Michael Faraday sentó las bases de la electroquímica y los iones en estado sólido al descubrir el movimiento de los iones en electrolitos líquidos y sólidos. Antes, alrededor de 1800, Alessandro Volta utilizó un electrolito líquido en su pila voltaica , la primera batería electroquímica, pero no se dio cuenta de que en el proceso intervienen iones. Mientras tanto, en su trabajo sobre la descomposición de soluciones mediante corriente eléctrica, Faraday utilizó no solo las ideas de ion , catión , anión , electrodo , ánodo , cátodo , electrolito y electrólisis , sino incluso los términos actuales para ellos. [4] [5] Faraday asoció la corriente eléctrica en un electrolito con el movimiento de los iones, y descubrió que los iones pueden intercambiar sus cargas con un electrodo mientras se transformaban en elementos mediante electrólisis. Cuantificó esos procesos mediante dos leyes de la electrólisis . La primera ley (1832) estableció que la masa de un producto en el electrodo, Δm, aumenta linealmente con la cantidad de carga que pasa a través del electrolito, Δq. La segunda ley (1833) estableció la proporcionalidad entre Δm y el “equivalente electroquímico” y definió la constante de Faraday F como F = (Δq/Δm)(M/z), donde M es la masa molar y z es la carga del ion.
En 1834, Faraday descubrió la conductividad iónica en electrolitos sólidos calentados Ag 2 S y PbF 2 . [4] En PbF 2 , el aumento de la conductividad al calentarse no fue repentino, sino que se extendió a lo largo de cien grados Celsius. Este comportamiento, llamado transición de Faraday, [6] se observa en los conductores catiónicos Na 2 S y Li 4 SiO 4 y en los conductores aniónicos PbF 2 , CaF 2 , SrF 2 , SrCl 2 y LaF 3 . [2]
Más tarde, en 1891, Johann Wilhelm Hittorf informó sobre los números de transporte de iones en celdas electroquímicas, [7] y a principios del siglo XX esos números se determinaron para electrolitos sólidos. [8]
La pila voltaica estimuló una serie de baterías mejoradas, como la celda Daniell , la celda de combustible y la batería de plomo-ácido . Su funcionamiento se comprendió en gran medida a finales del siglo XIX a partir de las teorías de Wilhelm Ostwald y Walther Nernst . En 1894, Ostwald explicó la conversión de energía en una pila de combustible y destacó que su eficiencia no estaba limitada por la termodinámica . [9] Ostwald, junto con Jacobus Henricus van 't Hoff y Svante Arrhenius , fue uno de los padres fundadores de la electroquímica y la teoría química iónica, y recibió el premio Nobel de química en 1909.
Su trabajo fue continuado por Walther Nernst, quien derivó la ecuación de Nernst y describió la conducción iónica en circonio dopado heterovalentemente , que utilizó en su lámpara Nernst . Nernst se inspiró en la teoría de la disociación de Arrhenius publicada en 1887, que se basaba en iones en solución. [10] En 1889 se dio cuenta de la similitud entre los equilibrios electroquímicos y químicos, y formuló su ecuación que predijo correctamente el voltaje de salida de varias celdas electroquímicas basadas en electrolitos líquidos a partir de las propiedades termodinámicas de sus componentes. [11]
Además de su trabajo teórico, en 1897 Nernst patentó la primera lámpara que utilizaba un electrolito sólido. [12] A diferencia de las lámparas de filamento de carbono existentes, la lámpara de Nernst podía funcionar en el aire y era dos veces más eficiente ya que su espectro de emisión era más cercano al de la luz del día. AEG, una empresa de iluminación de Berlín, compró la patente de Nernst por un millón de marcos de oro alemanes , lo que en aquel momento era una fortuna, y utilizó 800 lámparas de Nernst para iluminar su stand en la feria mundial Exposition Universelle (1900) . [2]

Entre varios electrolitos sólidos descritos en el siglo XIX y principios del XX, el α-AgI, la forma cristalina de yoduro de plata de alta temperatura, se considera ampliamente como el más importante. Su conducción eléctrica fue caracterizada por Carl Tubandt y E. Lorenz en 1914. [13] Su estudio comparativo de AgI, AgCl y AgBr demostró que α-AgI es térmicamente estable y altamente conductora entre 147 y 555 °C; la conductividad aumentó débilmente con la temperatura en este rango y luego disminuyó al fundirse. Este comportamiento fue totalmente reversible y excluyó los efectos de desequilibrio. Tubandt y Lorenz describieron otros materiales con un comportamiento similar, como α-CuI, α-CuBr, β-CuBr y fases de alta temperatura de Ag 2 S, Ag 2 Se y Ag 2 Te. [14] Asociaron la conductividad con cationes en haluros de plata y cuprosos y con iones y electrones en calcogenuros de plata.

En 1926, Yakov Frenkel sugirió que en un cristal iónico como AgI, en equilibrio termodinámico, una pequeña fracción de los cationes, α, se desplazan de sus sitios regulares de la red a posiciones intersticiales. [15] Relacionó α con la energía de Gibbs para la formación de un mol de pares de Frenkel, ΔG, como α = exp(-ΔG/2RT), donde T es la temperatura y R es la constante del gas ; para un valor típico de ΔG = 100 kJ/mol, α ~ 1 × 10−6 a 100 °C y ~6 × 10−4 a 400 °C. Naturalmente, esta idea explicaba la presencia de una fracción apreciable de iones móviles en cristales iónicos que, por lo demás, estaban libres de defectos y, por tanto, la conductividad iónica en ellos. [2]
La idea de Frenkel fue ampliada por Carl Wagner y Walter Schottky en su teoría de 1929, que describía la termodinámica de equilibrio de los defectos puntuales en cristales iónicos. En particular, Wagner y Schottky relacionaron las desviaciones de la estequiometría en esos cristales con los potenciales químicos de los componentes del cristal y explicaron el fenómeno de la conducción mixta electrónica e iónica. [16] [17]
Wagner y Schottky consideraron cuatro casos extremos de trastorno de defecto puntual en un cristal iónico binario estequiométrico de tipo AB: [17]
El trastorno de tipo 3 no ocurre en la práctica, y el tipo 2 se observa solo en casos raros cuando los aniones son más pequeños que los cationes, mientras que los tipos 1 y 4 son comunes y muestran la misma dependencia de la temperatura exp(-ΔG/2RT). [2]
Más tarde, en 1933, Wagner sugirió que en los óxidos metálicos un exceso de metal daría como resultado electrones adicionales, mientras que un déficit de metal produciría agujeros de electrones, es decir, que la no estequiometría atómica daría como resultado una conducción mixta iónico-electrónica. [18]
Los estudios de conductores iónicos cristalinos donde el exceso de iones se proporcionaba por defecto puntual continuaron durante la década de 1950, y se estableció el mecanismo de conducción específico para cada compuesto dependiendo de su estructura iónica. La aparición de electrolitos vítreos y poliméricos a finales de la década de 1970 proporcionó nuevos mecanismos de conducción iónica. En los vidrios se logró un rango relativamente amplio de conductividades, en los que los iones móviles se desacoplaban dinámicamente de la matriz. [19] Se descubrió que la conductividad se podía aumentar dopando un vidrio con ciertas sales o usando una mezcla de vidrio. Los valores de conductividad podrían llegar a 0,03 S/cm a temperatura ambiente, con energías de activación tan bajas como 20 kJ/mol. [20] En comparación con los cristales, los vidrios tienen propiedades isotrópicas , una composición continuamente sintonizable y buena trabajabilidad; carecen de los perjudiciales límites de grano y pueden moldearse en cualquier forma, pero comprender su transporte iónico fue complicado por la falta de orden de largo alcance. [2]
Históricamente, se proporcionó evidencia de la conductividad iónica en la década de 1880, cuando los científicos alemanes notaron que un termómetro bien calibrado hecho de vidrio de Turingia mostraría -0,5 °C en lugar de 0 °C cuando se colocaba en hielo poco después de sumergirlo en agua hirviendo. y recuperarse sólo después de varios meses. En 1883, redujeron este efecto 10 veces reemplazando una mezcla de sodio y potasio en el vaso por sodio o potasio. [21] Este hallazgo ayudó a Otto Schott a desarrollar el primer termómetro preciso a base de litio. En 1884 aparecieron estudios más sistemáticos sobre la conductividad iónica en el vidrio, [22] pero recibieron amplia atención sólo un siglo después. Se han formulado empíricamente varias leyes universales para los vidrios iónicos y se han extendido a otros conductores iónicos, como la dependencia de la frecuencia de la conductividad eléctrica σ(ν) – σ(0) ~ ν p , donde el exponente p depende del material, pero no de temperatura, al menos por debajo de ~ 100 K. Este comportamiento es una huella digital de la conducción de salto activada entre sitios cercanos. [2]
En 1975, Peter V. Wright, un químico especializado en polímeros de Sheffield (Reino Unido), produjo el primer electrolito polimérico que contenía sales de sodio y potasio en una matriz de óxido de polietileno (PEO). [23] Más tarde se propuso otro tipo de electrolitos poliméricos, el polielectrolito , en el que los iones se movían a través de una matriz polimérica cargada eléctricamente, en lugar de neutra. Los electrolitos poliméricos mostraron conductividades más bajas que los vidrios, pero eran más baratos, mucho más flexibles y podían mecanizarse y moldearse más fácilmente en diversas formas. [24] Mientras que los vidrios iónicos normalmente funcionan por debajo, los conductores poliméricos normalmente se calientan por encima de sus temperaturas de transición vítrea . En consecuencia, tanto el campo eléctrico como la deformación mecánica decaen en una escala de tiempo similar en los polímeros, pero no en los vidrios. [19] [24] Entre 1983 y 2001 se creía que la fracción amorfa es responsable de la conductividad iónica, es decir, que el desorden estructural (casi) completo es esencial para el rápido transporte iónico en los polímeros. [19] Sin embargo, en 2001 y posteriormente se describieron varios polímeros cristalinos con una conductividad iónica de hasta 0,01 S/cm a 30 °C y una energía de activación de sólo 0,24 eV. [2]
En las décadas de 1970 y 1980, se descubrió que los sistemas de tamaño nanométrico podían afectar la conductividad iónica, abriendo un nuevo campo de la nanoiónica . En 1973, se informó que la conductividad iónica de los cristales de yoduro de litio (LiI) podía aumentarse 50 veces añadiéndoles un polvo fino de material "aislante" (alúmina). [25] Este efecto se reprodujo en la década de 1980 en haluros de Ag y Tl dopados con nanopartículas de alúmina. [26] [27] [28] De manera similar, la adición de nanopartículas aislantes ayudó a aumentar la conductividad de los polímeros iónicos. [29] [30] Estos resultados inesperados se explicaron por la separación de carga en la interfaz matriz-nanopartícula que proporcionó canales conductores adicionales a la matriz, y se requirió el pequeño tamaño de las partículas de relleno para aumentar el área de esta interfaz. [26] Se observaron efectos de separación de carga similares para los límites de grano en conductores iónicos cristalinos. [2]
En 1971, se diseñaron y probaron pilas y baterías de estado sólido basadas en yoduro de plata y rubidio (RbAg 4 I 5 ) en una amplia gama de temperaturas y corrientes de descarga. [31] A pesar de la conductividad relativamente alta de RbAg 4 I 5 , nunca se han comercializado debido a su bajo contenido energético general por unidad de peso (aprox. 5 W·h/kg). [32] Por el contrario, LiI, que tenía una conductividad de sólo ca. 1 × 10−7 S/cm a temperatura ambiente, encontró una aplicación a gran escala en baterías para marcapasos artificiales . El primer dispositivo de este tipo, basado en LiI no dopado, se implantó en un ser humano en marzo de 1972 en Ferrara , Italia. [33] Los modelos posteriores utilizaron como electrolito una película de LiI, que fue dopada con nanopartículas de alúmina para aumentar su conductividad. [25] El LiI se formó en unareacción química in situ entre el ánodo de Li y el cátodo de yodo-poli( 2-vinilpiridina ) y, por lo tanto, se autocuró de la erosión y las grietas durante la operación. [34]
Las celdas de sodio-azufre, basadas en electrolito cerámico β-Al 2 O 3 intercalado entre un ánodo de sodio fundido y un cátodo de azufre fundido, mostraron altas densidades de energía y se consideraron para baterías de automóviles en la década de 1990, pero se descartaron debido a la fragilidad de la alúmina, que resultó en grietas y fallas críticas debido a la reacción entre el sodio fundido y el azufre. El reemplazo de β-Al 2 O 3 con NASICON no salvó esta solicitud porque no resolvió el problema de craqueo y porque NASICON reaccionó con el sodio fundido. [2]
La circona estabilizada con itria se utiliza como electrolito sólido en sensores de oxígeno en automóviles, generando un voltaje que depende de la proporción de oxígeno y gases de escape y proporcionando retroalimentación electrónica al inyector de combustible. [35] Estos sensores también se instalan en muchas fábricas metalúrgicas y de fabricación de vidrio. [36] En las décadas de 1980 y 1990 se propusieron sensores similares de CO 2 , cloro y otros gases basados en electrolitos de haluro de plata sólidos. [2] Desde mediados de la década de 1980, se utiliza un electrolito sólido a base de Li para separar la película electrocrómica (típicamente WO 3 ) y la película de almacenamiento de iones (típicamente LiCoO 2 ) en el vidrio inteligente , [37] una ventana cuya transparencia está controlada por tensión externa. [38]
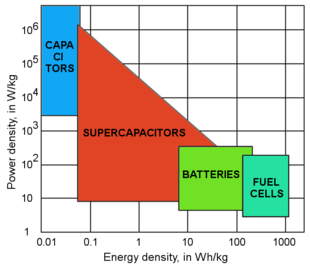
Los conductores iónicos de estado sólido son componentes esenciales de las baterías de iones de litio , las pilas de combustible de membrana de intercambio de protones (PEMFC), los supercondensadores , una nueva clase de dispositivos de almacenamiento de energía electroquímica, y las pilas de combustible de óxido sólido , dispositivos que producen electricidad a partir de la oxidación de un combustible. Nafion , un fluoropolímero - copolímero flexible descubierto a finales de la década de 1960, se utiliza ampliamente como electrolito polimérico en PEMFC. [2]
{{cite journal}}: Falta o está vacío |title=( ayuda )