En química orgánica , un haluro de acilo (también conocido como haluro de ácido ) es un compuesto químico derivado de un oxoácido [1] al reemplazar un grupo hidroxilo ( −OH ) con un grupo haluro ( −X , donde X es un halógeno ). [2]
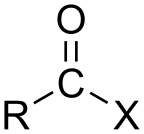
Si el ácido es un ácido carboxílico ( −C(=O)OH ), el compuesto contiene un grupo funcional −C(=O)X , que consiste en un grupo carbonilo ( C=O ) unido de forma sencilla a un átomo de halógeno. [3] La fórmula general para dicho haluro de acilo se puede escribir RCOX , donde R puede ser, por ejemplo, un grupo alquilo , CO es el grupo carbonilo y X representa el haluro, como el cloruro . Los cloruros de acilo son los haluros de acilo más comunes, pero el yoduro de acetilo es el que se produce (transitoriamente) a mayor escala. Anualmente se generan miles de millones de kilogramos en la producción de ácido acético . [4]
A escala industrial, la reacción del anhídrido acético con cloruro de hidrógeno produce una mezcla de cloruro de acetilo y ácido acético: [5]
Las síntesis comunes de cloruros de acilo también implican la reacción de ácidos carboxílicos con fosgeno , cloruro de tionilo [6] y tricloruro de fósforo [7]. El pentabromuro de fósforo se utiliza para bromuros de acilo, que rara vez son valiosos.
El cloruro de benzoilo se produce a partir de benzotricloruro utilizando agua o ácido benzoico : [8]
Al igual que otros cloruros de acilo , se puede generar a partir del ácido original y otros agentes clorantes, como pentacloruro de fósforo o cloruro de tionilo .
Las rutas de laboratorio representativas para los haluros de acilo aromáticos son comparables a las de los haluros de acilo alifáticos. [9] Por ejemplo, la cloroformilación, un tipo específico de acilación de Friedel-Crafts que utiliza formaldehído como reactivo [ cita requerida ] , o mediante la cloración directa de derivados de benzaldehído . [10]
De interés comercial, los cloruros de acilo reaccionan con HF para dar fluoruros de acilo . [11] Los fluoruros de acilo aromáticos (así como los alifáticos) se preparan convenientemente directamente a partir de ácidos carboxílicos, utilizando productos químicos básicos estables y económicos: PPh3, NBS y Et3N-3HF en un protocolo de sobremesa . [12] El fluoruro cianúrico convierte los ácidos carboxílicos en fluoruros de acilo. [13]
Los ácidos carboxílicos reaccionan con tetrafluoruro de azufre para dar fluoruro de acilo: [14]
Los bromuros y yoduros de acilo se sintetizan en consecuencia, pero son menos comunes. [15]
Los haluros de acilo son compuestos bastante reactivos que suelen sintetizarse para utilizarse como intermediarios en la síntesis de otros compuestos orgánicos. Por ejemplo, un haluro de acilo puede reaccionar con:
En las reacciones anteriores, también se forma HX ( haluro de hidrógeno o ácido hidrohálico). Por ejemplo, si el haluro de acilo es un cloruro de acilo, también se forma HCl ( cloruro de hidrógeno o ácido clorhídrico ).

Una molécula puede tener más de un grupo funcional de haluro de acilo. Por ejemplo, el "dicloruro de adipoilo", normalmente llamado simplemente cloruro de adipoilo , tiene dos grupos funcionales de cloruro de acilo ; vea la estructura a la derecha. Es el dicloruro (es decir, cloruro doble) del ácido adípico, un ácido dicarboxílico de 6 carbonos . Un uso importante del cloruro de adipoilo es la polimerización con un compuesto orgánico diamino para formar una poliamida llamada nailon o la polimerización con otros compuestos orgánicos determinados para formar poliésteres .
El fosgeno (dicloruro de carbonilo, Cl–CO–Cl) es un gas muy tóxico que es el dicloruro de ácido carbónico (HO–CO–OH). Ambos átomos de cloro en el fosgeno pueden experimentar reacciones análogas a las reacciones anteriores de los haluros de acilo. El fosgeno se utiliza como reactivo en la producción de polímeros de policarbonato , entre otras aplicaciones industriales.
Los haluros de acilo volátiles son lacrimógenos porque pueden reaccionar con el agua en la superficie del ojo produciendo ácidos hidrohalógenos y orgánicos que irritan los ojos. Pueden surgir problemas similares si se inhalan vapores de haluros de acilo. En general, los haluros de acilo (incluso compuestos no volátiles como el cloruro de tosilo ) son irritantes para los ojos, la piel y las membranas mucosas .