
Los fragmentos de Okazaki son secuencias cortas de nucleótidos de ADN (de aproximadamente 150 a 200 pares de bases de longitud en eucariotas ) que se sintetizan de forma discontinua y luego se unen entre sí por la enzima ADN ligasa para crear la hebra rezagada durante la replicación del ADN . [1] Fueron descubiertos en la década de 1960 por los biólogos moleculares japoneses Reiji y Tsuneko Okazaki , junto con la ayuda de algunos de sus colegas.
Durante la replicación del ADN, la doble hélice se desenrolla y las hebras complementarias se separan por la enzima ADN helicasa , creando lo que se conoce como la horquilla de replicación del ADN . Después de esta horquilla, la ADN primasa y la ADN polimerasa comienzan a actuar para crear una nueva hebra complementaria. Debido a que estas enzimas solo pueden trabajar en la dirección 5' a 3', las dos hebras molde desenrolladas se replican de diferentes maneras. [2] Una hebra, la hebra líder , experimenta un proceso de replicación continuo ya que su hebra molde tiene direccionalidad 3' a 5', lo que permite que la polimerasa que ensambla la hebra líder siga la horquilla de replicación sin interrupción. La hebra rezagada, sin embargo, no se puede crear de manera continua porque su hebra molde tiene direccionalidad 5' a 3', lo que significa que la polimerasa debe trabajar hacia atrás desde la horquilla de replicación. Esto causa interrupciones periódicas en el proceso de creación de la hebra rezagada. La primasa y la polimerasa se mueven en dirección opuesta a la bifurcación, por lo que las enzimas deben detenerse y comenzar de nuevo repetidamente mientras la helicasa de ADN separa las hebras. Una vez que se forman los fragmentos, la ligasa de ADN los conecta en una sola hebra continua. [3] Todo el proceso de replicación se considera "semidiscontinuo", ya que una de las nuevas hebras se forma de forma continua y la otra no. [4]
[2] Durante la década de 1960, Reiji y Tsuneko Okazaki realizaron experimentos que involucraban la replicación del ADN en la bacteria Escherichia coli . Antes de esta época, se creía comúnmente que la replicación era un proceso continuo para ambas cadenas, pero los descubrimientos relacionados con E. coli llevaron a un nuevo modelo de replicación. Los científicos descubrieron que había un proceso de replicación discontinuo al marcar el ADN con pulsos y observar cambios que apuntaban a una replicación no contigua.
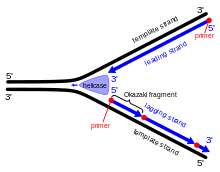
El trabajo de Kiwako Sakabe, Reiji Okazaki y Tsuneko Okazaki proporcionó evidencia experimental que apoya la hipótesis de que la replicación del ADN es un proceso discontinuo. Anteriormente, se aceptaba comúnmente que la replicación era continua tanto en la dirección 3' a 5' como en la dirección 5' a 3'. 3' y 5' son carbonos específicamente numerados en el anillo de desoxirribosa en los ácidos nucleicos, y se refieren a la orientación o direccionalidad de una hebra. En 1967, Tsuneko Okazaki y Toru Ogawa sugirieron que no se ha encontrado ningún mecanismo que muestre una replicación continua en la dirección 3' a 5', solo 5' a 3' utilizando la ADN polimerasa , una enzima de replicación. El equipo planteó la hipótesis de que si se utilizaba la replicación discontinua, las hebras cortas de ADN , sintetizadas en el punto de replicación, podrían unirse en la dirección 5' a 3' a la hebra más antigua. [5]
Para distinguir experimentalmente el método de replicación utilizado por el ADN, el equipo marcó con pulsos áreas recién replicadas de cromosomas de Escherichia coli , desnaturalizó y extrajo el ADN. Una gran cantidad de unidades cortas radiactivas significaba que el método de replicación probablemente era discontinuo. La hipótesis fue respaldada además por el descubrimiento de la polinucleótido ligasa , una enzima que une hebras cortas de ADN. [6]
En 1968, Reiji y Tsuneko Okazaki reunieron evidencia adicional de cadenas de ADN nacientes. Plantearon la hipótesis de que si la replicación discontinua, que involucra cadenas cortas de ADN unidas entre sí por la polinucleótido ligasa, es el mecanismo utilizado en la síntesis de ADN, entonces "las cadenas cortas de ADN recién sintetizadas se acumularían en la célula en condiciones en las que la función de la ligasa se ve temporalmente alterada". E. coli se infectó con el bacteriófago T4 que produce polinucleótido ligasa sensible a la temperatura. Las células infectadas con los fagos T4 acumularon una gran cantidad de cadenas cortas de ADN recién sintetizadas, como se predijo en la hipótesis, cuando se expusieron a altas temperaturas. Este experimento respaldó aún más la hipótesis de Okazakis de replicación y unión discontinuas por polinucleótido ligasa. Refutó también la noción de que las cadenas cortas también se producían durante el proceso de extracción. [7]
Los experimentos de Okazakis proporcionaron amplia información sobre el proceso de replicación del ADN y la existencia de cadenas cortas de ADN recién sintetizadas que más tarde se conocieron como fragmentos de Okazaki.
Se han propuesto dos vías para procesar los fragmentos de Okazaki: la vía del colgajo corto y la vía del colgajo largo.
En la vía del colgajo corto en eucariotas, la cadena rezagada de ADN se prepara en intervalos cortos. En la vía corta, solo participa la nucleasa FEN1 . La Pol δ encuentra con frecuencia el fragmento de Okazaki preparado corriente abajo y desplaza el cebador iniciador de ARN/ADN hacia un colgajo 5'. La endonucleasa FEN1 5'-3' reconoce que el colgajo 5' está desplazado y lo escinde, creando un sustrato para la ligadura. En este método, se elimina el cebador sintetizado por Pol a. Los estudios [ ¿cuáles? ] muestran que en la FEN1 se sugiere un modelo de "rastreo" en el que la nucleasa se mueve desde el colgajo 5' hasta su base para realizar la escisión. La Pol δ no procesa una actividad de nucleasa para escindir el colgajo desplazado. La FEN1 escinde el colgajo corto inmediatamente después de que se forma. La escisión se inhibe cuando el extremo 5' de la solapa de ADN se bloquea con un cebador complementario o una fracción de estreptavidina conjugada con biotina. La ADN ligasa sella la muesca hecha por el FEN1 y crea una doble cadena funcional continua de ADN. PCNA simula las funciones enzimáticas de las proteínas tanto para FEN1 como para la ADN ligasa. La interacción es crucial para crear una ligadura adecuada de la cadena de ADN rezagada. El desplazamiento y la escisión secuencial de la cadena por Pol δ y FEN1, respectivamente, ayudan a eliminar todo el ARN iniciador antes de la ligadura. Se necesitan muchos desplazamientos y reacciones de escisión para eliminar el cebador iniciador. La solapa que se crea y procesa y madura por la vía de la solapa corta.
En algunos casos, el FEN1 dura solo un corto período de tiempo y se desacopla del complejo de replicación. Esto provoca un retraso en la escisión y las aletas desplazadas por Pol δ se vuelven largas. Cuando el RPA alcanza una longitud suficiente, puede unirse de forma estable. Cuando las aletas unidas al RPA se refactorizan para la escisión de FEN1, se requiere otra nucleasa para su procesamiento, que se ha identificado como una nucleasa alternativa, DNA2. DNA2 tiene defectos en la sobreexpresión de DEN1. Se ha demostrado que DNA2 funciona con FEN1 para procesar aletas largas. DNA2 puede disociar el RPA de una aleta larga, lo hace utilizando un mecanismo como el FEN1. Se une a la aleta y enhebra el extremo 5' de la aleta. La nucleasa corta la aleta, lo que la hace demasiado corta para unirse al RPA; si la aleta es demasiado corta, significa que está disponible para FEN1 y la ligadura. Esto se conoce como el método de la aleta larga. DNA2 puede actuar como FEN1 como respaldo de la actividad de la nucleasa, pero no es un proceso eficiente.
Hasta hace poco, sólo se conocían dos vías para procesar los fragmentos de Okazaki. Sin embargo, las investigaciones actuales han llegado a la conclusión de que existe una nueva vía para la fragmentación de Okazaki y la replicación del ADN. Esta vía alternativa implica a las enzimas Pol δ con Pif1, que realizan el mismo proceso de eliminación de colgajos que Pol δ y FEN1. [8]

La primasa añade cebadores de ARN a la hebra rezagada, lo que permite la síntesis de fragmentos de Okazaki desde 5' hasta 3'. Sin embargo, la primasa crea cebadores de ARN a una velocidad mucho menor que la que utiliza la ADN polimerasa para sintetizar ADN en la hebra líder. La ADN polimerasa de la hebra rezagada también tiene que reciclarse continuamente para construir fragmentos de Okazaki después de los cebadores de ARN. Esto hace que la velocidad de síntesis de la hebra rezagada sea mucho menor que la de la hebra líder. Para solucionar esto, la primasa actúa como una señal de parada temporal, deteniendo brevemente la progresión de la horquilla de replicación durante la replicación del ADN. Este proceso molecular evita que la hebra líder supere a la hebra rezagada. [9]
Durante esta fase, las enzimas sintetizan ADN en la dirección 5' a 3'. La ADN polimerasa es esencial tanto para la cadena líder, que se forma como una cadena continua, como para la cadena rezagada, que se forma en pequeños fragmentos en la síntesis de ADN. Este proceso ocurre para la extensión del fragmento recién sintetizado y la expulsión del segmento de ARN y ADN. La síntesis ocurre en 3 fases con dos polimerasas diferentes, la ADN polimerasa α-primasa y la ADN polimerasa δ. Este proceso comienza con el desplazamiento de la polimerasa α-primasa del cebador de ARN y ADN por el efecto de replicación del cargador de pinza, este efecto hace que la pinza deslizante se coloque sobre el ADN. Después de esto, la ADN polimerasa δ comienza a adoptar su forma de holoenzima, que luego comienza la síntesis. El proceso de síntesis continuará hasta que llegue el extremo 5' del fragmento de Okazaki anterior. Una vez llegado, el procesamiento del fragmento de Okazaki procede a unir el fragmento recién sintetizado a la cadena rezagada. La última función de la ADN polimerasa δ es servir como complemento a la actividad de la endonucleasa de 5' Flap FEN1/RAD27. El alelo rad27-p es letal en la mayoría de las combinaciones, pero era viable con la polimerasa rad27-p y exo1. Tanto la polimerasa rad27-p como exo1 presentan fuertes aumentos sinérgicos en las mutaciones de duplicación de CAN 1. La única razón por la que esta mutación es viable se debe a los genes de reparación de roturas de doble cadena RAD50, RAD51 y RAD52. El RAD27/FEN1 crea mellas entre fragmentos de Okazaki adyacentes al minimizar la cantidad de expulsión de cadena en la cadena rezagada.
Durante la síntesis de la cadena rezagada, la ADN ligasa I conecta los fragmentos de Okazaki, tras el reemplazo de los cebadores de ARN con nucleótidos de ADN por la ADN polimerasa δ. Los fragmentos de Okazaki que no están ligados podrían causar roturas de doble cadena, lo que corta el ADN. [10] Dado que solo se tolera una pequeña cantidad de roturas de doble cadena, y solo una pequeña cantidad puede repararse, una cantidad suficiente de fallos de ligadura podría ser letal para la célula.
Investigaciones posteriores implican el papel complementario del antígeno nuclear de células proliferantes (PCNA) a la función de la ADN ligasa I de unir fragmentos de Okazaki. Cuando el sitio de unión del PCNA en la ADN ligasa I está inactivo, la capacidad de la ADN ligasa I para conectar fragmentos de Okazaki se ve gravemente afectada. Por lo tanto, se propone un mecanismo: después de que un complejo PCNA-ADN polimerasa δ sintetice fragmentos de Okazaki, se libera la ADN polimerasa δ. Luego, la ADN ligasa I se une al PCNA, que se sujeta a las muescas de la hebra rezagada, y cataliza la formación de enlaces fosfodiéster. [11] [12] [13]
La endonucleasa de flap 1 ( FEN1 ) es responsable del procesamiento de los fragmentos de Okazaki. Trabaja con la ADN polimerasa para eliminar el cebador de ARN de un fragmento de Okazaki y puede eliminar el ribonucleótido 5' y los flaps 5' cuando la ADN polimerasa desplaza las hebras durante la síntesis de la hebra rezagada. La eliminación de estos flaps implica un proceso llamado traducción de mellas y crea una mella para la ligadura. Por lo tanto, la función de FEN1 es necesaria para la maduración del fragmento de Okazaki en la formación de una hebra de ADN larga y continua. Del mismo modo, durante la reparación de la base del ADN, el nucleótido dañado se desplaza hacia una mella y posteriormente es eliminado por FEN1. [14] [15]
La endonucleasa Dna2 no tiene una estructura específica y sus propiedades no están bien caracterizadas, pero se la podría denominar ADN monocatenario con extremos libres (ssDNA). La endonucleasa Dna2 es esencial para cortar los largos colgajos de ADN que salen de FEN1 durante el proceso de Okazaki. La endonucleasa Dna2 es responsable de la eliminación del segmento de ARN iniciador en los fragmentos de Okazaki. Además, la endonucleasa Dna2 tiene un papel fundamental en los intermediarios creados durante diversos metabolismos del ADN y es funcional en el mantenimiento de los telómeros. [16] [17] [18] [19] [20]
La endonucleasa Dna2 se activa cuando un segmento terminal de ARN se une al extremo 5', porque se transloca en la dirección 5' a 3'. En presencia de una proteína de unión a ADN monocatenario RPA, las solapas 5' del ADN se vuelven demasiado largas y las muescas ya no sirven como sustrato para FEN1. Esto impide que FEN1 elimine las solapas 5'. Por lo tanto, el papel de Dna2 es reducir el extremo 3' de estos fragmentos, lo que permite que FEN1 corte las solapas y la maduración del fragmento de Okazaki sea más eficiente. Durante el proceso de Okazaki, la helicasa y la endonucleasa Dna2 son inseparables. La endonucleasa Dna2 no depende de la estructura de horquilla de cola 5' de su actividad. Se sabe que la unión improductiva crea bloqueos para la escisión y el seguimiento de FEN1. Se sabe que el ATP reduce la actividad, pero promueve la liberación de la etiqueta del extremo 3'. Los estudios han sugerido que un nuevo modelo de endonucleasa Dna2 y FEN1 son parcialmente responsables de la maduración del fragmento de Okazaki. [19] [17] [16] [21]
El ADN recién sintetizado, también conocido como fragmentos de Okazaki, se une mediante la ligasa del ADN, que forma una nueva cadena de ADN. Hay dos cadenas que se crean cuando se sintetiza el ADN. La cadena líder se sintetiza continuamente y se alarga durante este proceso para exponer la plantilla que se utiliza para la cadena rezagada (fragmentos de Okazaki). Durante el proceso de replicación del ADN, los cebadores de ADN y ARN se eliminan de la cadena rezagada de ADN para permitir que los fragmentos de Okazaki se unan a ella. Dado que este proceso es tan común, la maduración de Okazaki tendrá lugar alrededor de un millón de veces durante la finalización de una replicación de ADN. Para que se produzca la maduración de Okazaki, los cebadores de ARN deben crear segmentos en los fragmentos que se van a ligar. Esto se utiliza como un bloque de construcción para la síntesis de ADN en la cadena rezagada. En la cadena de plantilla, la polimerasa sintetizará en la dirección opuesta a la de la horquilla de replicación. Una vez que la plantilla se vuelve discontinua, creará un fragmento de Okazaki. Los defectos en la maduración de los fragmentos de Okazaki pueden provocar la ruptura de cadenas de ADN y causar diferentes formas de anomalías cromosómicas. Estas mutaciones en los cromosomas pueden afectar la apariencia, el número de conjuntos o el número de cromosomas individuales. Dado que los cromosomas son fijos para cada especie específica, también pueden cambiar el ADN y causar defectos en el acervo genético de esa especie.
Los fragmentos de Okazaki están presentes tanto en procariotas como en eucariotas . [22] Las moléculas de ADN en eucariotas se diferencian de las moléculas circulares de procariotas en que son más grandes y generalmente tienen múltiples orígenes de replicación. Esto significa que cada cromosoma eucariota está compuesto de muchas unidades replicantes de ADN con múltiples orígenes de replicación. En comparación, el ADN procariota tiene un solo origen de replicación. En eucariotas, estas horquillas de replicación, que son numerosas a lo largo del ADN, forman "burbujas" en el ADN durante la replicación. La horquilla de replicación se forma en un punto específico llamado secuencias de replicación autónoma (ARS). Los eucariotas tienen un complejo cargador de pinzas y una pinza de seis unidades llamada antígeno nuclear de célula proliferante. [23] El movimiento eficiente de la horquilla de replicación también depende críticamente de la colocación rápida de pinzas deslizantes en sitios recién preparados en la cadena de ADN rezagada por complejos cargadores de pinzas dependientes de ATP. Esto significa que la generación por partes de fragmentos de Okazaki puede seguir el ritmo de la síntesis continua de ADN en la cadena principal. Estos complejos de cargadores de pinza son característicos de todos los eucariotas y separan algunas de las pequeñas diferencias en la síntesis de fragmentos de Okazaki en procariotas y eucariotas. [24] Las longitudes de los fragmentos de Okazaki en procariotas y eucariotas también son diferentes. Los procariotas tienen fragmentos de Okazaki que son bastante más largos que los de los eucariotas. Los eucariotas suelen tener fragmentos de Okazaki de entre 100 y 200 nucleótidos de longitud, mientras que los fragmentos en E. coli procariota pueden tener 2000 nucleótidos de longitud. Se desconoce la razón de esta discrepancia.
Cada cromosoma eucariota está compuesto de muchas unidades replicantes de ADN con múltiples orígenes de replicación. En comparación, el cromosoma procariota de E. coli tiene un solo origen de replicación. La replicación en procariotas ocurre dentro del citoplasma, y todo esto inicia la replicación que está formada por aproximadamente 100 a 200 o más nucleótidos. Las moléculas de ADN eucariota tienen un número significativamente mayor de replicones , aproximadamente 50.000 o más; sin embargo, la replicación no ocurre al mismo tiempo en todos los replicones. En eucariotas, la replicación del ADN tiene lugar en el núcleo. Se forma una plétora de replicaciones en solo una molécula de ADN replicante, el inicio de la replicación del ADN es desplazado por la proteína de múltiples subunidades. Esta replicación es lenta y, a veces, se agregan alrededor de 100 nucleótidos por segundo.
De esto se deduce que las células procariotas tienen una estructura más simple, no tienen núcleo, ni organelos, y muy poco ADN, en forma de un solo cromosoma. Las células eucariotas tienen núcleo con múltiples organelos y más ADN dispuesto en cromosomas lineales. También vemos que el tamaño es otra diferencia entre estas células procariotas y eucariotas. La célula eucariota promedio tiene alrededor de 25 veces más ADN que una célula procariota. La replicación ocurre mucho más rápido en las células procariotas que en las células eucariotas; las bacterias a veces tardan solo 40 minutos, mientras que las células animales pueden tardar hasta 400 horas. Los eucariotas también tienen una operación distinta para replicar los telómeros al final de sus últimos cromosomas. Los procariotas tienen cromosomas circulares, lo que hace que no haya extremos para sintetizar. Los procariotas tienen un proceso de replicación corto que ocurre de forma continua; las células eucariotas, por otro lado, solo emprenden la replicación del ADN durante la fase S del ciclo celular .
Las similitudes son los pasos para la replicación del ADN. Tanto en procariotas como en eucariotas, la replicación se logra desenrollando el ADN mediante una enzima llamada helicasa de ADN. Las nuevas hebras se crean mediante enzimas llamadas ADN polimerasas. Ambas siguen un patrón similar, llamado replicación semiconservativa, en la que las hebras individuales de ADN se producen en diferentes direcciones, lo que da lugar a una hebra líder y otra rezagada. Estas hebras rezagadas se sintetizan mediante la producción de fragmentos de Okazaki que pronto se unen. Ambos organismos comienzan a formar nuevas hebras de ADN que también incluyen pequeñas hebras de ARN.
Aunque las células pasan por múltiples pasos para garantizar que no haya mutaciones en la secuencia genética, a veces las deleciones específicas y otros cambios genéticos durante la maduración del fragmento de Okazaki pasan desapercibidos. Debido a que los fragmentos de Okazaki son el conjunto de nucleótidos de la cadena rezagada, cualquier alteración, incluidas las deleciones, inserciones o duplicaciones de la cadena original, puede causar una mutación si no se detecta y corrige. Otras causas de mutaciones incluyen problemas con las proteínas que ayudan en la replicación del ADN. Por ejemplo, una mutación relacionada con la primasa afecta la eliminación del cebador del ARN y puede hacer que la cadena de ADN sea más frágil y susceptible a las roturas. Otra mutación se refiere a la polimerasa α, que afecta a la edición de la secuencia del fragmento de Okazaki y la incorporación de la proteína al material genético. Ambas alteraciones pueden provocar aberraciones cromosómicas, reordenamiento genético involuntario y una variedad de cánceres más adelante en la vida. [25]
Para probar los efectos de las mutaciones de la proteína en organismos vivos, los investigadores alteraron genéticamente ratones de laboratorio para que fueran homocigotos para otra mutación en la proteína relacionada con la replicación del ADN, la endonucleasa flap 1 o FEN1. Los resultados variaron según las alteraciones genéticas específicas. Los ratones mutantes knockout homocigotos experimentaron un "fracaso de la proliferación celular" y "letalidad embrionaria temprana" (27). Los ratones con la mutación F343A y F344A (también conocida como FFAA) murieron directamente después del nacimiento debido a complicaciones en el nacimiento, incluyendo pancitopenia e hipoplasia pulmonar . Esto se debe a que la mutación FFAA impide que FEN1 interactúe con PCNA (antígeno nuclear de células proliferantes), lo que no le permite completar su propósito durante la maduración del fragmento de Okazaki. La interacción con esta proteína se considera la función molecular clave en la función biológica de FEN1. La mutación FFAA causa defectos en la eliminación del cebador del ARN y en la reparación de pares de bases largos, lo que provoca muchas roturas en el ADN. Si se observa con atención, las células homocigotas para las mutaciones FFAA FEN1 parecen mostrar solo defectos parciales en la maduración, lo que significa que los ratones heterocigotos para la mutación podrían sobrevivir hasta la edad adulta, a pesar de tener múltiples pequeñas muescas en sus genomas. Sin embargo, inevitablemente, estas muescas impiden la futura replicación del ADN porque la rotura hace que la horquilla de replicación colapse y causa roturas de doble cadena en la secuencia real del ADN. Con el tiempo, estas muescas también causan roturas cromosómicas completas, lo que podría provocar mutaciones graves y cánceres. Se han implementado otras mutaciones con versiones alteradas de la polimerasa α, que han dado lugar a resultados similares. [25]