Los 1,3-difosfa-2,4-diboretanos , o B 2 P 2 , son una clase de compuestos cíclicos de 4 miembros con átomos de boro y fósforo alternados . A menudo se encuentran como dímeros durante la síntesis de borafosfenos (RB=PR'). [1] Los compuestos pueden exhibir un carácter dirradical singlete localizado (dirradicaloide) entre los átomos de boro en solución y en estado sólido. [2]
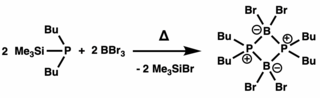
La primera síntesis sugerida de un compuesto difosfadiboretanos fue con dimerización de fosfinoarilboranos en 1961. [3] Al mismo tiempo, se determinó que se producía un difosfadiboretanos a partir de la reacción con fosfinosilanos y haluros de boro. [4] [5] El siguiente tratamiento de termólisis formó borafosfenos por escisión de los enlaces σ P-Si. La dimerización de estos compuestos es altamente favorecida (hasta 90 kcal mol −1 ), lo que da como resultado difosfadiboretanos aislados. [1] También se han descubierto rutas alternativas de síntesis que utilizan grupos salientes fáciles, incluida la eliminación de haluro de hidrógeno y organilfosfano para obtener los precursores de monómeros. También se ha descubierto que el tratamiento con haluros de boro con fosfuros de litio conduce a monómeros que luego se dimerizan en difosfadiboretanos. [6]
En 2002, se logró una síntesis directa de un difosfadiboretanediilo, un derivado del difosfadiboretano, utilizando 1,2-diclorodiborano y un reactivo de fosfuro de litio. [2]

En 2021, se descubrió que la fosfinación de diborina con difosfato se convertiría lentamente en difosfadiboretano en solución. [7]


Los difosfadiboretanos se pueden aislar como cristales individuales adecuados para la cristalografía de rayos X. [1] [5] [6] [7] Se ha descubierto que la estructura es plana, con una geometría casi cuadrada. La distancia BB oscila entre 2,57 y 2,71 Å, lo que indica un enlace simple BB largo. Los átomos de fósforo adoptan geometrías piramidales, que se prefieren a una geometría plana y evitan la unión π con los átomos de boro. [2] [6]
Los derivados de difosfadiboretandiilo tienen un rango estructural más amplio, adoptando geometrías planares y biciclo[1.1.0], similares a los difosfacilobutanodiilos. [8] Estas geometrías pueden modularse cambiando los sustituyentes en los átomos de boro o fósforo. Esta conversión va acompañada de un alargamiento y acortamiento del enlace BB, respectivamente. La adición de más grupos protectores estéricos en los átomos de boro y menos grupos estéricos en los átomos de fósforo favorece la estructura biciclo[1.1.0]. Esto último se debe a la reducción de la tensión 1,3-diaxial . El enlace π coplanar al átomo de boro y la adición de grupos aromáticos al anillo favorecen la estructura biciclo[1.1.0] con una longitud de enlace BB acortada hasta 1,83 Å. [1] [8]

En las estructuras planas de difosfadiboretanediilo, se puede considerar que el enlace BB sustancialmente largo experimenta una escisión homolítica para formar un dirradicaloide singlete localizado entre los átomos de boro. [8] La energía del estado singlete puede ser hasta 20-35 kcal mol −1 más estabilizada que el estado triplete . [9] Se ha descubierto que la adición de donantes π en el átomo de boro aumenta la brecha singlete-triplete, mientras que los aceptores π la disminuyen. Se considera que la estructura biciclo[1.1.0], con un enlace BB más corto, tiene un carácter menos dirradical y más un sistema de capa cerrada . [8]
El HOMO de estos difosfadiboretanediilos consiste en un orbital π con un fuerte carácter de orbital p de boro. [2] Este orbital se estabiliza por la presencia de una superposición π entre los átomos de boro trans (interacciones a través del espacio) así como por las contribuciones a través del enlace de los orbitales PR σ*. Debido a la presencia de la interacción a través del espacio, los estudios computacionales han determinado que estos compuestos tienen un carácter dirradical significativamente menor que los dirradical orgánicos tradicionales. [10] [11] El LUMO es el orbital antienlazante π* BB. [7]

Se ha demostrado que los difosfadiboretanos se comportan como ligandos de complejos de metal-carbonilo , formando arquitecturas boro-mononuclear, boro-binuclear, η 3 y η 4 con desplazamiento de ligandos CO. [12] Si se utilizan sustituyentes estéricos que contienen amino en el boro, se produce una reacción de ciclorreversión. Esto da como resultado la producción de borafosfeno estabilizado con metal. También se han descrito compuestos de jaula (B 2 P 2 M, M = Pd, Pt) con coordinación η 2 con los átomos de P. [13]

La síntesis de difosfadiboretano a partir de diborino ofrece un compuesto rico en dos electrones, en comparación con los difosfadiboretanediilos. [7] Estos electrones se pueden oxidar fácilmente , lo que proporciona el compuesto catiónico radical y el compuesto difosfadiboretanediilo. Se encontró que el catión radical exhibe un estado triplete por resonancia paramagnética electrónica , acompañado de un acortamiento del enlace BB (2,63 Å) y una ligera perturbación de la estructura plana y cuadrada. Se encontró que el compuesto difosfadiboretanediilo tiene un enlace BB de 2,12 Å y la transición a la estructura biciclo[1.1.0]. El análisis del orbital de enlace natural del compuesto fosfadiboretanediilo indica un enlace BB doblado con una pequeña energía de estabilización de 3 kcal mol −1 en comparación con la estructura plana.

Los difosfadiboretandiilos exhiben una reactividad similar a los radicales , comportándose como intermediarios dirradicales. [8] Se ha demostrado que los compuestos realizan la abstracción de cloruro a partir de cloroformo deuterado , la trans -adición de hidruro de trimetil estaño y la formación de la estructura biciclo[1.1.1] con selenio . La reactividad se muestra hacia el bromotriclorometano donde la actividad radical induce la formación de un compuesto espiro que contiene boro a partir del grupo terc -butilo . Esta formación cíclica mantiene la estructura del anillo de difosfadiboretano.
