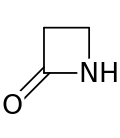
Un anillo de β-lactama ( beta- lactama ) es una lactama de cuatro miembros . [1] Una lactama es una amida cíclica , y las betalactamas se denominan así porque el átomo de nitrógeno está unido al átomo de carbono β en relación con el carbonilo. La β-lactama más simple posible es la 2-azetidinona. Las β-lactámas son unidades estructurales significativas de medicamentos como se manifiesta en muchos antibióticos β-lactámicos . [2] Hasta 1970, la mayoría de la investigación sobre β-lactamas se centraba en los grupos de penicilina y cefalosporina , pero desde entonces, se ha descrito una amplia variedad de estructuras. [3] [4]
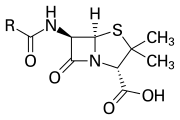
El anillo β-lactámico es parte de la estructura central de varias familias de antibióticos , siendo las principales las penicilinas , cefalosporinas , carbapenémicos y monobactámicos , que, por lo tanto, también se denominan antibióticos β-lactámicos . Casi todos estos antibióticos funcionan inhibiendo la biosíntesis de la pared celular bacteriana . Esto tiene un efecto letal sobre las bacterias , aunque cualquier población bacteriana dada normalmente contendrá un subgrupo que es resistente a los antibióticos β-lactámicos. La resistencia bacteriana se produce como resultado de la expresión de uno de los muchos genes para la producción de β-lactamasas , una clase de enzimas que rompen el anillo β-lactámico. Se han documentado más de 1.800 enzimas β-lactamasas diferentes en varias especies de bacterias. [5] Estas enzimas varían ampliamente en su estructura química y eficiencias catalíticas. [6] Cuando las poblaciones bacterianas tienen estos subgrupos resistentes, el tratamiento con β-lactama puede hacer que la cepa resistente se vuelva más prevalente y, por lo tanto, más virulenta. Los antibióticos derivados de β-lactama pueden considerarse una de las clases de antibióticos más importantes, pero propensas a la resistencia clínica. La β-lactama exhibe sus propiedades antibióticas al imitar el sustrato natural d-Ala-d-Ala para el grupo de enzimas conocidas como proteínas de unión a penicilina (PBP), que tienen como función reticular la parte de peptidoglicano de la pared celular de las bacterias. [7]
El anillo β-lactámico también se encuentra en otros medicamentos, como el fármaco inhibidor de la absorción de colesterol ezetimiba .
La primera β-lactama sintética fue preparada por Hermann Staudinger en 1907 mediante la reacción de la base de Schiff de anilina y benzaldehído con difenilceteno [8] [9] en una cicloadición [2+2] (Ph indica un grupo funcional fenilo ):
Se han desarrollado muchos métodos para la síntesis de β-lactamas. [10] [11] [12]
La síntesis de β-lactamas de Breckpot [13] produce β-lactamas sustituidas mediante la ciclización de ésteres de beta aminoácidos mediante el uso de un reactivo de Grignard . [14] El reactivo de Mukaiyama también se utiliza en la síntesis de Breckpot modificada. [13]
Debido a la tensión del anillo , las β-lactamas se hidrolizan más fácilmente que las amidas lineales o las lactamas más grandes. Esta tensión aumenta aún más mediante la fusión a un segundo anillo, como se encuentra en la mayoría de los antibióticos β-lactámicos. Esta tendencia se debe a que el carácter amida de la β-lactama se reduce por la aplanaridad del sistema. El átomo de nitrógeno de una amida ideal tiene hibridación sp2 debido a la resonancia , y los átomos con hibridación sp2 tienen una geometría de enlace trigonal planar . A medida que la tensión del anillo fuerza una geometría de enlace piramidal sobre el átomo de nitrógeno, la resonancia del enlace amida se reduce y el carbonilo se vuelve más parecido a una cetona . El premio Nobel Robert Burns Woodward describió un parámetro h como una medida de la altura de la pirámide trigonal definida por el nitrógeno (como el vértice ) y sus tres átomos adyacentes. h corresponde a la fuerza del enlace β-lactámico, siendo los números más bajos (más planos; más parecidos a las amidas ideales) más fuertes y menos reactivos. [15] Los monobactámicos tienen valores h entre 0,05 y 0,10 angstroms (Å). Los cefemas tienen valores h de 0,20-0,25 Å. Los penams tienen valores en el rango de 0,40-0,50 Å, mientras que los carbapenémicos y clavams tienen valores de 0,50-0,60 Å, siendo los más reactivos de los β-lactámicos hacia la hidrólisis. [16]