El hidruro de litio es un compuesto inorgánico con la fórmula Li H. Este hidruro de metal alcalino es un sólido incoloro, aunque las muestras comerciales son grises. Característica de un hidruro (iónico) similar a una sal , tiene un alto punto de fusión y no es soluble pero sí reactivo con todos los disolventes orgánicos próticos . Es soluble y no reacciona con ciertas sales fundidas como el fluoruro de litio , el borohidruro de litio y el hidruro de sodio . Con una masa molar de 7,95 g/mol, es el compuesto iónico más ligero .
LiH es un conductor diamagnético e iónico con una conductividad que aumenta gradualmente desde2 × 10 −5 Ω −1 cm −1 a 443 °C a 0,18 Ω −1 cm −1 a 754 °C; no hay discontinuidad en este aumento a través del punto de fusión. [3] : 36 La constante dieléctrica del LiH disminuye de 13,0 (frecuencias bajas, estáticas) a 3,6 (frecuencias de luz visible). [3] : 35 LiH es un material blando con una dureza Mohs de 3,5. [3] : 42 Su fluencia compresiva (cada 100 horas) aumenta rápidamente de < 1% a 350 °C a > 100% a 475 °C, lo que significa que el LiH no puede proporcionar soporte mecánico cuando se calienta. [3] : 39
La conductividad térmica del LiH disminuye con la temperatura y depende de la morfología: los valores correspondientes son 0,125 W/(cm·K) para cristales y 0,0695 W/(cm·K) para compactos a 50 °C, y 0,036 W/(cm·K) para cristales. K) para cristales y 0,0432 W/(cm·K) para compactos a 500 °C. [3] : 60 El coeficiente de expansión térmica lineal es 4,2 × 10−5 /°C a temperatura ambiente. [3] : 49
El LiH se produce tratando litio metálico con gas hidrógeno :
Esta reacción es especialmente rápida a temperaturas superiores a 600 °C. La adición de 0,001 a 0,003 % de carbono y/o el aumento de la temperatura y/o la presión aumenta el rendimiento hasta un 98 % con un tiempo de residencia de 2 horas. [3] : 147 Sin embargo, la reacción se produce a temperaturas tan bajas como 29 °C. El rendimiento es del 60% a 99 °C y del 85% a 125 °C, y la tasa depende significativamente de la condición de la superficie del LiH. [3] : 5
Las formas menos comunes de síntesis de LiH incluyen la descomposición térmica de hidruro de litio y aluminio (200 °C), borohidruro de litio (300 °C), n -butillitio (150 °C) o etillitio (120 °C), así como varias reacciones que involucran compuestos de litio de baja estabilidad y contenido de hidrógeno disponible. [3] : 144–145
Las reacciones químicas producen LiH en forma de polvo granulado , que se puede comprimir en bolitas sin aglutinante . Se pueden producir formas más complejas mediante fundición a partir de la masa fundida . [3] : 160 y sigs. Luego se pueden cultivar monocristales grandes (de unos 80 mm de largo y 16 mm de diámetro) a partir de polvo de LiH fundido en una atmósfera de hidrógeno mediante la técnica de Bridgman-Stockbarger . Suelen tener un color azulado debido a la presencia de Li coloidal . Este color se puede eliminar mediante recocido posterior al crecimiento a temperaturas más bajas (~550 °C) y gradientes térmicos más bajos. [3] : 154 Las principales impurezas en estos cristales son Na (20–200 ppm ), O (10–100 ppm), Mg (0,5–6 ppm), Fe (0,5-2 ppm) y Cu (0,5-2 ppm). . [3] : 155
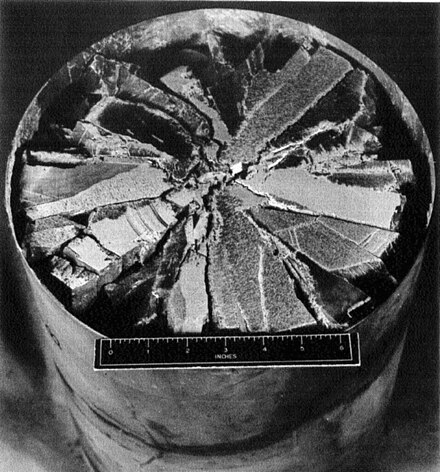
Las piezas de LiH prensadas en frío a granel se pueden mecanizar fácilmente utilizando técnicas y herramientas estándar con precisión micrométrica . Sin embargo, el LiH fundido es quebradizo y se agrieta fácilmente durante el procesamiento. [3] : 171
Una ruta más eficiente desde el punto de vista energético para formar polvo de hidruro de litio es moler litio metálico con bolas bajo alta presión de hidrógeno. Un problema con este método es la soldadura en frío del metal litio debido a su alta ductilidad . Añadiendo pequeñas cantidades de polvo de hidruro de litio se puede evitar la soldadura en frío. [7]
El polvo de LiH reacciona rápidamente con el aire de baja humedad , formando LiOH , Li 2 O y Li 2 CO 3 . En aire húmedo, el polvo se enciende espontáneamente, formando una mezcla de productos que incluye algunos compuestos nitrogenados. El material en masa reacciona con el aire húmedo, formando una capa superficial, que es un fluido viscoso. Esto inhibe una mayor reacción, aunque la aparición de una película de "deslustre" es bastante evidente. Se forma poco o nada de nitruro al exponerse al aire húmedo. El material en trozos, contenido en un plato de metal, puede calentarse al aire hasta una temperatura ligeramente inferior a 200 °C sin inflamarse, aunque se inflama fácilmente cuando se toca con una llama abierta. El estado de la superficie del LiH, la presencia de óxidos en la cápsula metálica, etc., tienen un efecto considerable sobre la temperatura de ignición. El oxígeno seco no reacciona con el LiH cristalino a menos que se caliente fuertemente, cuando se produce una combustión casi explosiva. [3] : 6
LiH es altamente reactivo con el agua y otros reactivos próticos : [3] : 7
El LiH es menos reactivo con el agua que el Li y, por tanto, es un agente reductor mucho menos potente para el agua, los alcoholes y otros medios que contienen solutos reducibles . Esto es cierto para todos los hidruros salinos binarios . [3] : 22
Los gránulos de LiH se expanden lentamente en el aire húmedo, formando LiOH ; sin embargo, la tasa de expansión es inferior al 10% en 24 horas a una presión de 2 Torr de vapor de agua. [3] : 7 Si el aire húmedo contiene dióxido de carbono , entonces el producto es carbonato de litio . [3] : 8 LiH reacciona con amoníaco lentamente a temperatura ambiente, pero la reacción se acelera significativamente por encima de 300 °C. [3] : 10 LiH reacciona lentamente con alcoholes superiores y fenoles , pero vigorosamente con alcoholes inferiores. [3] : 14
El LiH reacciona con el dióxido de azufre para dar el ditionito :
aunque por encima de 50 °C el producto es sulfuro de litio . [3] : 9
El LiH reacciona con el acetileno para formar carburo de litio e hidrógeno . Con ácidos orgánicos anhidros , fenoles y anhídridos de ácido , el LiH reacciona lentamente, produciendo gas hidrógeno y la sal de litio del ácido. Con ácidos que contienen agua, el LiH reacciona más rápido que con agua. [3] : 8 Muchas reacciones de LiH con especies que contienen oxígeno producen LiOH, que a su vez reacciona irreversiblemente con LiH a temperaturas superiores a 300 °C: [3] : 10
El hidruro de litio no reacciona a temperaturas moderadas con O 2 o Cl 2 . Por lo tanto, se utiliza en la síntesis de otros hidruros útiles, [8] por ejemplo,
Con un contenido de hidrógeno en proporción a su masa tres veces mayor que el del NaH, el LiH tiene el mayor contenido de hidrógeno de todos los hidruros. El LiH resulta periódicamente de interés para el almacenamiento de hidrógeno, pero sus aplicaciones se han visto frustradas por su estabilidad ante la descomposición. Así, la eliminación del H 2 requiere temperaturas superiores a los 700 °C utilizadas para su síntesis, temperaturas que son costosas de crear y mantener. El compuesto se probó una vez como componente de combustible en un modelo de cohete. [9] [10]
El LiH no suele ser un agente reductor de hidruros, excepto en la síntesis de hidruros de ciertos metaloides. Por ejemplo, el silano se produce en la reacción de hidruro de litio y tetracloruro de silicio mediante el proceso de Sundermeyer:
El hidruro de litio se utiliza en la producción de una variedad de reactivos para síntesis orgánica , como el hidruro de litio y aluminio ( Li[AlH 4 ] ) y el borohidruro de litio ( Li[BH 4 ] ). El trietilborano reacciona para dar superhidruro ( Li [BH( CH2CH3 ) 3 ] ) . [11]
El hidruro de litio (LiH) es a veces un material deseable para el blindaje de reactores nucleares , con el isótopo litio-6 (Li-6), y puede fabricarse mediante fundición. [12] [13]
El deuteruro de litio, en forma de deuteruro de litio-7 ( 7 Li 2 H o 7 LiD), es un buen moderador para los reactores nucleares , porque el deuterio ( 2 H o D) tiene una sección transversal de absorción de neutrones más baja que el hidrógeno o el protio ordinarios. ( 1 H) sí, y la sección transversal de 7 Li también es baja, lo que disminuye la absorción de neutrones en un reactor. Se prefiere 7 Li como moderador porque tiene una sección transversal de captura de neutrones más baja y también forma menos tritio ( 3 H o T) bajo bombardeo con neutrones. [14]
El correspondiente deuteruro de litio-6 ( 6 Li 2 H o 6 LiD) es el principal combustible de fusión en las armas termonucleares . En las ojivas de hidrógeno del diseño Teller-Ulam , un disparador de fisión nuclear explota para calentar y comprimir el deuteruro de litio-6 y bombardear el 6 LiD con neutrones para producir tritio en una reacción exotérmica :
Luego, el deuterio y el tritio se fusionan para producir helio , un neutrón y 17,59 MeV de energía libre en forma de rayos gamma , energía cinética , etc. El helio es un subproducto inerte.
Antes de la prueba de armas nucleares de Castle Bravo en 1954, se pensaba que sólo el isótopo menos común 6 Li produciría tritio al ser golpeado con neutrones rápidos. La prueba de Castle Bravo demostró (accidentalmente) que el 7 Li, más abundante, también lo hace en condiciones extremas, aunque mediante una reacción endotérmica .
El LiH reacciona violentamente con el agua para dar hidrógeno gaseoso y LiOH, que es cáustico. En consecuencia, el polvo de LiH puede explotar en aire húmedo o incluso en aire seco debido a la electricidad estática. En concentraciones de 5 a 55 mg/m 3 en el aire, el polvo es extremadamente irritante para las membranas mucosas y la piel y puede provocar una reacción alérgica. Debido a la irritación, el cuerpo normalmente rechaza el LiH en lugar de acumularlo. [3] : 157, 182
Algunas sales de litio, que pueden producirse en reacciones de LiH, son tóxicas. El fuego de LiH no debe extinguirse utilizando dióxido de carbono, tetracloruro de carbono o extintores acuosos; se debe sofocar cubriéndolo con un objeto metálico o con polvo de grafito o dolomita . La arena es menos adecuada, ya que puede explotar cuando se mezcla con LiH ardiente, especialmente si no está seca. El LiH normalmente se transporta en aceite, utilizando recipientes de cerámica, determinados plásticos o acero, y se manipula en una atmósfera de argón o helio seco. [3] : 156 Se puede utilizar nitrógeno, pero no a temperaturas elevadas, ya que reacciona con el litio. [3] : 157 LiH normalmente contiene algo de litio metálico, que corroe los contenedores de acero o sílice a temperaturas elevadas. [3] : 173–174, 179