En química organometálica , las reglas de Green-Davies-Mingos predicen la regioquímica de la adición nucleofílica a complejos metálicos de 18 electrones que contienen múltiples ligandos insaturados . [1] Las reglas fueron publicadas en 1978 por los químicos organometálicos Stephen G. Davies , Malcolm Green y Michael Mingos . Describen cómo y dónde los hidrocarburos insaturados generalmente se vuelven más susceptibles al ataque nucleofílico tras la formación de complejos. [1]
Se prefiere el ataque nucleofílico en polienos pares ( hapticidad par ). [1]

Los nucleófilos prefieren agregar polienos acíclicos en lugar de polienos cíclicos. [1]

Los nucleófilos añaden preferentemente ligandos de polieno de hapticidad uniforme en un extremo. [1] Los nucleófilos se agregan a ligandos de polieno acíclico de hapticidad impar en una posición terminal si el metal es altamente electrofílico; de lo contrario, se agregan en un sitio interno.
Simplificado: incluso antes que impar y abierto antes que cerrado
El siguiente es un diagrama que muestra las tendencias de reactividad de hapticidad par/impar y ligandos π abiertos/cerrados.
El centro metálico es aceptor de electrones. Este efecto se potencia si el metal también está unido a un carbonilo. Los metales pobres en electrones no se unen bien al carbonilo. Cuanto más aceptor de electrones tiene el metal, más carácter de triple enlace tiene el ligando CO. Esto le da al ligando una constante de fuerza más alta. La constante de fuerza resultante encontrada para un carbonilo ligado representa la misma constante de fuerza para los ligandos π si reemplazan al ligando CO en el mismo complejo.
La adición nucleofílica no ocurre si kCO* (la constante de fuerza efectiva para el ligando de CO) está por debajo de un valor umbral [2]
La siguiente figura muestra un metal ligado unido a un grupo carbonilo. Este grupo tiene una carga positiva parcial y por tanto es susceptible al ataque nucleofílico. Si el ligando representado por L n fuera un ligando π, también se activaría hacia el ataque nucleofílico.
El ataque nucleofílico entrante ocurre en uno de los extremos del sistema π en la siguiente figura:
En este ejemplo, se puede considerar que el sistema de anillos es análogo al 1,3-butadieno. Siguiendo las reglas de Green-Davies-Mingos, dado que el butadieno es un ligando π abierto de hapticidad uniforme, se producirá un ataque nucleofílico en una de las posiciones terminales del sistema π. Esto ocurre porque el LUMO del butadieno tiene lóbulos más grandes en los extremos que en las posiciones internas.
Ataque nucleofílico en la posición terminal de ligandos alilo cuando está presente el ligando aceptor π . [3]
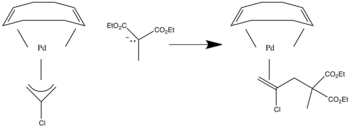
Si hay ligandos donantes sigma, bombean electrones al ligando y el ataque se produce en la posición interna.

Cuando hay ligandos de alilo asimétricos, el ataque se produce en la posición más sustituida. [4]
En este caso, el ataque se producirá en el carbono con ambos grupos R unidos, ya que esa es la posición más sustituida.
La adición nucleófila a ligandos π se puede utilizar en síntesis. Un ejemplo de esto es la producción de compuestos metálicos cíclicos. [5] Los nucleófilos se añaden al centro del ligando π y producen un metalobutano.

