La mupirocina , que se vende bajo la marca Bactroban , entre otras, es un antibiótico tópico útil contra infecciones superficiales de la piel como el impétigo o la foliculitis . [5] [6] [7] También se puede utilizar para eliminar el S. aureus resistente a la meticilina (MRSA) cuando está presente en la nariz sin síntomas. [6] Debido a las preocupaciones por el desarrollo de resistencia , no se recomienda su uso durante más de diez días. [7] Se utiliza como crema o ungüento aplicado sobre la piel. [6]
Los efectos secundarios comunes incluyen picazón y sarpullido en el lugar de aplicación, dolor de cabeza y náuseas. [6] El uso a largo plazo puede provocar un mayor crecimiento de hongos . [6] El uso durante el embarazo y la lactancia parece ser seguro. [6] La mupirocina es químicamente un ácido carboxílico . [8] Funciona bloqueando la capacidad de una bacteria para producir proteínas, lo que generalmente resulta en la muerte bacteriana . [6]
La mupirocina se aisló inicialmente en 1971 de Pseudomonas fluorescens . [9] Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [10] En 2021, fue el medicamento número 203 más recetado en los Estados Unidos, con más de 2 millones de recetas. [11] [12] Está disponible como medicamento genérico . [13]

La mupirocina se utiliza como tratamiento tópico para infecciones bacterianas de la piel (por ejemplo, forúnculos , impétigo o heridas abiertas), que suelen deberse a infecciones por Staphylococcus aureus o Streptococcus pyogenes . También es útil en el tratamiento de infecciones superficiales por Staphylococcus aureus resistente a la meticilina (MRSA). [14] La mupirocina es inactiva para la mayoría de las bacterias anaeróbicas, micobacterias, micoplasmas, clamidia, levaduras y hongos. [15]
La mupirocina intranasal antes de la cirugía es eficaz para la prevención de la infección de la herida posoperatoria por Staphylcoccus aureus y el tratamiento preventivo intranasal o en el sitio del catéter es eficaz para reducir el riesgo de infección en el sitio del catéter en personas tratadas con diálisis peritoneal crónica. [16]
Poco después de que comenzara el uso clínico de la mupirocina, surgieron cepas de Staphylococcus aureus resistentes a la mupirocina, con tasas de eliminación de las fosas nasales de menos del 30% de éxito. [17] [18] Se aislaron dos poblaciones distintas de S. aureus resistentes a la mupirocina . Una cepa poseía resistencia de bajo nivel (MuL: MIC = 8–256 mg/L), y otra poseía resistencia de alto nivel (MuH: MIC > 256 mg/L). [17] La resistencia en las cepas MuL probablemente se deba a mutaciones en la isoleucil-ARNt sintetasa de tipo salvaje del organismo ( IleS ). En E. coli IleS , se demostró que una mutación de un solo aminoácido altera la resistencia a la mupirocina. [19] MuH está vinculada a la adquisición de un gen de Ile sintetasa separado, MupA . [20] La mupirocina no es un antibiótico viable contra las cepas MuH. Se ha demostrado que otros agentes antibióticos, como el ácido azelaico , la nitrofurazona , la sulfadiazina de plata y la ramoplanina , son eficaces contra las cepas de MuH. [17]
La mayoría de las cepas de Cutibacterium acnes , un agente causante de la enfermedad de la piel llamada acné vulgar , son naturalmente resistentes a la mupirocina. [21]
La mayoría de las cepas de Pseudomonas fluorescens también son resistentes a la mupirocina, ya que producen el antibiótico y es posible que otras especies de Pseudomonas también sean resistentes. [ cita requerida ]
El mecanismo de acción de la mupirocina difiere del de otros antibióticos clínicos, lo que hace que la resistencia cruzada con otros antibióticos sea poco probable. [17] Sin embargo, el gen MupA puede cotransferirse con otros genes de resistencia a los antibacterianos. Esto ya se ha observado con genes de resistencia al triclosán , la tetraciclina y la trimetoprima . [17] También puede provocar el crecimiento excesivo de organismos no susceptibles. [ cita requerida ]
En 2012 se descubrió un segundo tipo de sintetasa resistente de alto nivel, denominada MupB . Se la encontró en un aislado canadiense de SAMR "MUP87" y probablemente se encuentra en un plásmido no conjugativo. [22]
El ácido pseudomónico inhibe la isoleucina-ARNt ligasa en bacterias, [14] lo que conduce a la disminución de isoleucil-ARNt y la acumulación del ARNt no cargado correspondiente . La disminución de isoleucil-ARNt da como resultado la inhibición de la síntesis de proteínas . La forma no cargada del ARNt se une al sitio de unión aminoacil-ARNt de los ribosomas, lo que desencadena la formación de (p)ppGpp , que a su vez inhibe la síntesis de ARN. [23] La inhibición combinada de la síntesis de proteínas y la síntesis de ARN da como resultado la bacteriostasis. Este mecanismo de acción es compartido con la furanomicina , un análogo de la isoleucina. [24]
La inhibición de la ARNt ligasa/sintasa se produce por la similitud estructural entre la parte de la "cabeza" de la molécula, el ácido mónico, y el isoleucil- adenilato (Ile-AMS). La "cola" única del ácido 9-hidroxinonanoico envuelve la enzima y estabiliza aún más el complejo, manteniendo la parte catalítica adherida. [25] La mupirocina puede unirse a las versiones bacterianas y arqueales de la enzima, pero no a las eucariotas. [26]



La mupirocina es una mezcla de varios ácidos pseudomónicos, de los cuales el ácido pseudomónico A (PA-A) constituye más del 90 % de la mezcla. También están presentes en la mupirocina el ácido pseudomónico B con un grupo hidroxilo adicional en C8, [29] el ácido pseudomónico C con un doble enlace entre C10 y C11, en lugar del epóxido de PA-A, [30] y el ácido pseudomónico D con un doble enlace en C4` y C5` en la porción de ácido 9-hidroxi-nonanoico de la mupirocina. [31]
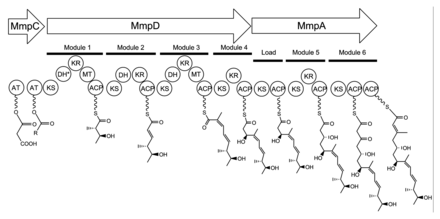
El grupo de genes de mupirocina de 74 kb contiene seis enzimas multidominio y otros veintiséis péptidos (Tabla 1). [27] Se codifican cuatro grandes proteínas policétido sintasa (PKS) multidominio de tipo I , así como varias enzimas de función única con similitud de secuencia con las PKS de tipo II. [27] Por lo tanto, se cree que la mupirocina está construida por un sistema PKS de tipo I y tipo II mixto. El grupo de mupirocina exhibe una organización atípica de aciltransferasa (AT), en el sentido de que solo hay dos dominios AT, y ambos se encuentran en la misma proteína, MmpC. Estos dominios AT son los únicos dominios presentes en MmpC, mientras que las otras tres proteínas PKS de tipo I no contienen dominios AT. [27] La vía de la mupirocina también contiene varios dobletes o tripletes de proteínas transportadoras de acilo en tándem . Esto puede ser una adaptación para aumentar la tasa de rendimiento o para unir múltiples sustratos simultáneamente. [27]
El ácido pseudomónico A es el producto de una esterificación entre el policétido 17C ácido mónico y el ácido graso 9C ácido 9-hidroxi-nonanoico. Se ha descartado la posibilidad de que toda la molécula se ensamble como un único policétido con una oxidación de Baeyer-Villiger que inserte un oxígeno en la cadena principal de carbono, ya que el C1 del ácido mónico y el C9' del ácido 9-hidroxi-nonanoico se derivan ambos del C1 del acetato. [32]
La biosíntesis de la unidad de ácido mónico 17C comienza en MmpD (Figura 1). [27] Uno de los dominios AT de MmpC puede transferir un grupo acetilo activado de la acetil-Coenzima A (CoA) al primer dominio ACP. La cadena se extiende por malonil-CoA, seguida de una metilación dependiente de SAM en C12 (ver Figura 2 para la numeración de PA-A) y la reducción del grupo B-ceto a un alcohol. Se predice que el dominio de deshidratación (DH) en el módulo 1 no será funcional debido a una mutación en la región del sitio activo conservado . El módulo 2 agrega otros dos carbonos por la unidad extensora malonil-CoA, seguido de cetorreducción (KR) y deshidratación. El módulo tres agrega una unidad extensora malonil-CoA, seguida de metilación dependiente de SAM en C8, cetorreducción y deshidratación. El módulo 4 extiende la molécula con una unidad malonil-CoA seguida de cetorreducción. [ cita requerida ]
El ensamblaje del ácido mónico continúa mediante la transferencia del producto 12C de MmpD a MmpA. [27]
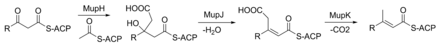
El grupo ceto en C3 se reemplaza con un grupo metilo en una reacción de varios pasos (Figura 3). MupG comienza descarboxilando un malonil-ACP. El carbono alfa del acetil-ACP resultante se une al C3 de la cadena de policétidos mediante MupH. Este intermediario se deshidrata y descarboxila mediante MupJ y MupK, respectivamente. [27]
La formación del anillo de pirano requiere muchos pasos mediados por enzimas (Figura 4). Se propone que el doble enlace entre C8 y C9 migre a entre C8 y C16. [28] Los experimentos de eliminación de genes de mupO, mupU, mupV y macpE han eliminado la producción de PA-A. [28] La producción de PA-B no se elimina mediante estas eliminaciones, lo que demuestra que PA-B no se crea mediante la hidroxilación de PA-A. Una eliminación de mupW eliminó el anillo de pirano, lo que identificó a MupW como un factor involucrado en la formación del anillo. [28]
Se cree que el epóxido de PA-A en C10-11 se inserta después de la formación de pirano por un citocromo P450 como MupO. [27] Una eliminación del gen mupO eliminó la producción de PA-A, pero permaneció PA-B, que también contiene el epóxido C10-C11. [28]
El ácido graso de nueve carbonos, el ácido 9-hidroxi-nonanoico (9-HN), se deriva como un compuesto separado y luego se esterifica al ácido mónico para formar ácido pseudomónico . La alimentación de acetato marcado con 13 C ha demostrado que C1-C6 se construyen con acetato de la manera canónica de la síntesis de ácidos grasos . C7' muestra solo el marcado de acetato con C1, mientras que C8' y C9' muestran un patrón inverso de acetato marcado con 13 C. [32] Se especula que C7-C9 surge de una unidad de inicio de 3-hidroxipropionato, que se extiende tres veces con malonil-CoA y se reduce completamente para producir 9-HN. También se ha sugerido que el 9-HN se inicia con ácido 3-hidroxi-3-metilglutárico (HMG). Esta última teoría no fue apoyada por la alimentación de [3- 14 C] o [3,6- 13 C 2 ]-HMG. [33]
Se propone que MmpB catalice la síntesis de 9-HN (Figura 5). MmpB contiene un dominio KS, KR, DH, 3 ACP y un dominio tioesterasa (TE). [27] No contiene un dominio enoil reductasa (ER), que sería necesario para la reducción completa al ácido graso de nueve carbonos. MupE es una proteína de un solo dominio que muestra similitud de secuencia con los dominios ER conocidos y puede completar la reacción. [27]