La fumonisina B1 es el miembro más frecuente de una familia de toxinas, conocidas como fumonisinas , producidas por múltiples especies de hongos del género Fusarium , como Fusarium verticillioides , que se encuentran principalmente en el maíz, el trigo y otros cereales. Se ha informado de la contaminación del maíz por fumonisina B1 en todo el mundo en niveles de mg/kg. La exposición humana se produce en niveles de microgramos a miligramos por día y es mayor en las regiones donde los productos de maíz son el alimento básico.
La fumonisina B 1 es hepatotóxica y nefrotóxica en todas las especies animales estudiadas. El primer cambio histológico que aparece en el hígado o el riñón de los animales tratados con fumonisina es un aumento de la apoptosis seguido de una proliferación celular regenerativa. Si bien la toxicidad aguda de la fumonisina es baja, es la causa conocida de dos enfermedades que se presentan en animales domésticos con una aparición rápida: leucoencefalomalacia equina y síndrome de edema pulmonar porcino. Ambas enfermedades implican un metabolismo alterado de los esfingolípidos y disfunción cardiovascular.
En 1970, un brote de leucoencefalomalacia en caballos en Sudáfrica se asoció con la contaminación del maíz con el hongo Fusarium verticillioides . [1] Es uno de los hongos transmitidos por semillas más frecuentes asociados con el maíz. [2] Se realizó otro estudio sobre el posible papel de las toxinas fúngicas en la etiología del cáncer de esófago humano en una región de Sudáfrica. La dieta de las personas que vivían en esta área era maíz de cosecha propia y F. verticillioides era el hongo más frecuente en el maíz consumido por las personas con alta incidencia de cáncer de esófago. [2] Otros brotes de leucoencefalomalacia y personas en ciertas regiones con alta incidencia de cáncer de esófago llevaron a más investigaciones sobre F. verticillioides . Pronto descubrieron experimentalmente que F. verticillioides causaba leucoencefalomalacia en caballos y edema pulmonar porcino en cerdos. Se descubrió que era altamente hepatotóxico y cardiotóxico en ratas. En 1984 se demostró que el hongo era hepatocarcinógeno en ratas. [2] La naturaleza química de los metabolitos causantes de todo esto aún no se había descubierto en 1984. Después del descubrimiento de la carcinogenicidad del hongo, el aislamiento y la caracterización química de las micotoxinas y carcinógenos producidos por F. verticillioides era urgente. No fue hasta 1988 que se desentrañara la naturaleza química del carcinógeno. La fumonisina B 1 y la fumonisina B 2 se aislaron de cultivos de F. verticillioides en el Programa de Micotoxinas y Carcinogénesis Experimental. [3] Las estructuras se dilucidaron en colaboración con el Consejo de Investigación Científica e Industrial. [4] Se han detectado varios isómeros de la fumonisina B1 en cultivos sólidos de arroz. [5] Ahora se conocen más de 100 fumonisinas diferentes, siendo las más importantes la fumonisina B 1 , B 2 y B 3 . [6] [7]
Respecto a la toxicocinética no hay datos disponibles en humanos, pero se han realizado investigaciones en animales.
La FB 1 se ingiere por vía oral a través de los alimentos. En general, la FB 1 se absorbe de forma deficiente, menos del 6 %. [8] La absorción de la fumonisina B 1 administrada por vía oral (10 mg/kg de peso corporal) a ratas es baja (3,5 % de la dosis) pero rápida (T máx. = 1,02 h). [9] La FB 1 no penetra significativamente a través de la piel humana y, por lo tanto, no presenta un riesgo sistémico significativo para la salud después de la exposición dérmica. [10]
Después de la absorción, una parte parece quedar retenida en el hígado y los riñones. En el caso de las ratas que fueron alimentadas con dietas que contenían fumonisinas durante varias semanas, las concentraciones de fumonisinas en los riñones fueron aproximadamente diez veces mayores que en el hígado. [11]
La distribución plasmática de la dosis absorbida se ajustó a un modelo abierto de dos compartimentos y los resultados del tiempo de concentración en el tejido (hígado, riñón) fueron consistentes con un modelo abierto de un compartimento . [9]
La vida media de eliminación en ratas es de 3,15 h para el plasma, 4,07 h para el hígado y 7,07 h para el riñón. [9] Sin embargo, la FB 1 se excreta rápidamente, principalmente en su forma original. Pequeñas cantidades se excretan en la orina; la mayor parte se excreta en las heces. [8]
Debido a su similitud, las fumonisinas pueden inhibir las esfingosina -esfinganina-transferasas y las ceramida sintasas y, por lo tanto, son inhibidores competitivos de la biosíntesis y el metabolismo de los esfingolípidos .

La Figura 2 muestra el metabolismo de los esfingolípidos (esquema) y la inhibición causada por las fumonisinas. La fumonisina B 1 inhibe la enzima ceramida sintasa (esfingosina N -aciltransferasa), que acila las bases esfingoides. Esto bloquea la formación de ceramida a través de dos vías. Inhibe la formación a través de esfinganina de novo y acil-CoA graso y a través de esfingosina producida por la degradación de la ceramida por la ceramidasa. La inhibición resulta en mayores concentraciones de esfinganina, esfingosina y sus metabolitos 1-fosfato y en menores concentraciones de esfingolípidos complejos. La acumulación de esfinganina y esfingosina es una causa primaria de la toxicidad de la fumonisina B 1 [13] . La esfinganina y la esfingosina son citotóxicas y tienen efectos inhibidores del crecimiento. Además, estas bases esfingoides inducen apoptosis. El aumento de la apoptosis parece desempeñar un papel importante en los efectos tóxicos, incluida la inducción de tumores. [8] Sin embargo, debe mencionarse que la concentración reducida de ceramida y la concentración aumentada de esfingosina-1-fosfato (como resultado de la ingesta de FB 1 ) causan una inhibición de la apoptosis y promueven la mitosis y la regeneración. [13] El equilibrio entre la concentración intracelular de compuestos que inhiben la apoptosis y los que la inducen determinará la respuesta celular. [14] Además, las concentraciones reducidas de esfingolípidos complejos parecen desempeñar un papel en el comportamiento anormal y la morfología alterada de las células afectadas. [11]
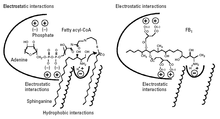
El mecanismo de acción propuesto se muestra en la figura 3. La fumonisina B 1 ocupa el espacio y las interacciones electrostáticas tanto de la esfinganina (o esfingosina) como del acil graso-CoA en la ceramida sintasa. La parte de la FB 1 que tiene similitud estructural con las bases esfingoides (la parte aminopentol) puede interactuar con el sitio de unión de la esfinganina, mientras que los grupos de ácido tricarbílico cargados negativamente pueden interactuar con el sitio de unión del acil graso-CoA. [8]
Debido a que el FB 1 también ocupa el espacio del acil-CoA graso, no se acila, ya que el acil-CoA es necesario para la acilación; el FB 1 solo inhibe la ceramida sintasa. Sin embargo, cuando los grupos de ácido tricarbílico se eliminan del FB 1 por hidrólisis, el producto resultante (aminopentol, AP1) no solo actúa como inhibidor, sino también como sustrato para la ceramida sintasa; el aminopentol es acilado por la ceramida sintasa para formar N-palmitoil-AP1. [13] Esto respalda la sugerencia de que la parte aminopentol del FB 1 ocupa el espacio de la esfinganina en la enzima. El N-palmitoil-AP1 es un inhibidor aún más potente de la ceramida sintasa y, por lo tanto, puede desempeñar un papel en la toxicidad de las fumonisinas nixtamalizadas. [13]
Los riesgos de la fumonisina B1 han sido evaluados por el Programa Internacional de Seguridad Química de la Organización Mundial de la Salud y el Comité Científico de Alimentos de la Comisión Europea. Determinaron una ingesta diaria tolerable para FB 1 , FB 2 , FB 3 , sola o en combinación de 2 μg / kg de peso corporal. [15] Hasta ahora, nada sobre la cinética y el metabolismo de la fumonisina B 1 en humanos ha sido reportado. En otros animales se han realizado muchas investigaciones, pero podrían no ser comparables a los humanos. En ratones, la eliminación de FB 1 es muy rápida, pero en humanos podría ser mucho más lenta considerando su peso corporal. [6] Hay varias vías posibles que causan efectos tóxicos de la fumonisina B 1 . La mayoría de los efectos tóxicos se deben a un metabolismo alterado de los esfingolípidos por inhibición de la ceramida sintasa. Podría ocurrir la producción de especies reactivas de oxígeno. Esto aumenta el estrés oxidativo e induce la peroxidación lipídica y podría dañar las células. En concordancia con esto, algunos estudios mostraron niveles disminuidos de glutatión en el hígado, pero otros estudios mostraron incluso niveles elevados de glutatión. [6] También se han reportado efectos citotóxicos. [6] Otro efecto de la exposición a FB 1 es la apoptosis. Esto se ha observado en varias células y tejidos diferentes. La inhibición de la ceramida sintasa no es responsable de este efecto. Los factores principales podrían ser la fragmentación del ADN y la activación de la caspasa-3. [6] FB 1 también tiene efectos inmunotóxicos, pero se necesita mucha más investigación para obtener una visión clara de los efectos sobre el sistema inmunológico.
Los defectos del tubo neural son anomalías del cerebro y la médula espinal en el embrión que resultan de la falla del cierre del tubo neural. [16] Estudios epidemiológicos y ensayos clínicos han señalado la deficiencia de folato como un factor de riesgo importante para los defectos del tubo neural. [17] La FB 1 altera el metabolismo de los esfingolípidos y, por lo tanto, esto podría afectar la absorción de folato y causar defectos del tubo neural. [6] En 1990 y 1991, un brote repentino de defectos del tubo neural ocurrió a lo largo de la frontera entre Texas y México. Se cree que este brote podría haberse debido a los altos niveles de FB 1 que se observaron en el maíz durante los años anteriores. [18] Las regiones de China y Sudáfrica con alto consumo de maíz también tienen una alta prevalencia de defectos del tubo neural. [6] [19]
Se cree que existe una relación entre la aparición de F. verticillioides y el cáncer de esófago humano. Un nivel socioeconómico bajo y una dieta poco variada, que consiste principalmente en maíz y trigo, se asocia con la aparición de cáncer de esófago. [6] Esto se deriva de estudios epidemiológicos en varios países. Otros estudios muestran que concentraciones más altas de FB 1 , FB 2 y F. verticillioides están presentes en el maíz que crece en regiones con un alto porcentaje de cáncer de esófago. Esto en contraste con regiones con bajos niveles de F. verticillioides , FB 1 y FB 2 en el maíz. [20] Además de esto, parece que las personas con un alto consumo de maíz tienen un mayor riesgo de desarrollar cáncer de esófago que las personas con un bajo consumo de maíz. Esto se observa en personas en regiones de Italia, Irán, Kenia, Zimbabwe, Estados Unidos y Brasil con alta incidencia de cáncer de esófago. [21] Otro estudio sobre la relación entre los niveles de esfingolípidos y la incidencia de cáncer no mostró ninguna relación significativa entre los esfingolípidos séricos y el riesgo de cáncer de esófago. Esto es bastante notable, porque se cree que los niveles elevados de esfingolípidos esfinganina y esfingosina son biomarcadores de la exposición a FB 1. [ 6]
La micotoxicosis aguda es una intoxicación alimentaria causada por productos alimenticios contaminados por hongos. En 1995, en 27 aldeas de la India se produjo un brote de esta enfermedad caracterizado por diarrea y dolor abdominal. Este brote se debió al consumo de sorgo y maíz mohosos debido a los daños causados por la lluvia. Se estudió este brote y se relacionó la micotoxicosis con el consumo de pan sin levadura. Se recogieron muestras de maíz y sorgo de los hogares y se examinaron. El maíz y el sorgo estaban contaminados por Fusarium y Aspergillus y contenían niveles elevados de FB 1 en comparación con las muestras de hogares no afectados. [6]
Se han realizado muchas investigaciones sobre los efectos tóxicos de la FB 1 en animales. Los estudios in vivo indican que el hígado y los riñones son los principales órganos diana. [6] Las fumonisinas se absorben mal, se eliminan rápidamente y no se metabolizan en los animales. [22] En cerdos y ratas hay una amplia distribución de FB 1 y se ha descubierto que pequeñas cantidades se acumulan solo en el hígado y los riñones. En los monos vervet , parte de la FB 1 se hidroliza parcialmente en el intestino. [6]
En ratas y ratones expuestos a FB 1 se produjo la formación de tumores. Se han realizado varios estudios sobre este tema. Dependiendo de la cepa de ratones utilizada se han demostrado diferentes carcinomas. [6] Se ha demostrado que FB 1 no es genotóxico. Por lo tanto, los mecanismos responsables del desarrollo del cáncer deberían estar en otra parte. Los mecanismos importantes para el desarrollo del cáncer debido a la fumonisina B 1 podrían ser el daño oxidativo (producción de especies reactivas de oxígeno) y la peroxidación lipídica. Los tumores hepáticos y renales también podrían deberse a la apoptosis por FB 1. Como respuesta a esto podría haber una regeneración continua de células, causando cáncer. Parece ser que el metabolismo alterado de los esfingolípidos es el factor causante de la carcinogenicidad inducida por FB 1 , como es el caso de los efectos tóxicos. [6] Con base en todos estos estudios en animales , la Agencia Internacional para la Investigación sobre el Cáncer (IARC) clasifica a FB 1 como posiblemente carcinógeno para humanos (Grupo 2B). [23]
El edema pulmonar porcino debido a FB 1 se ha estudiado intensamente desde el primer informe en 1981 de cerdos con edema pulmonar después de la exposición a maíz contaminado con F. verticillioides . Se han reportado alteraciones en la biosíntesis de esfingolípidos, especialmente en tejido pulmonar, cardíaco, renal y hepático. Se desarrolló un edema pulmonar letal dentro de los 4-7 días posteriores a la exposición al alimento con concentraciones de FB 1 >16 mg/kg de peso corporal (>92 partes por millón). Las dosis de 10 partes por millón causaron una forma más leve de edema pulmonar. [6]
La leucoencefalomalacia es una enfermedad neurotóxica de los caballos. Los brotes de esta enfermedad en el siglo XX dieron lugar a numerosos estudios. Aparentemente, la FB 1 era la causa de esta enfermedad. Se observaron niveles elevados de enzimas séricas que indican daño hepático. Normalmente se observaban por una elevación de la relación esfinganina/esfingosina. La FB 1 posiblemente induce la función cardiovascular, debido a la elevada relación esfinganina/esfingosina. Este podría ser uno de los principales factores que causan leucoencefalomalacia. [24]
Los efectos de la alimentación de ratas con FB 1 durante hasta 90 días fueron generalmente nefrotoxicidad. Entre diferentes cepas de ratas, la sensibilidad a FB 1 varió. En los riñones, el efecto principal fue la apoptosis. También se informó atrofia y regeneración tubular, así como disminución del peso del riñón. [6] Se informaron efectos histopatológicos en el hígado de la rata después de la exposición a corto y largo plazo. La causa principal fue la apoptosis. Los ratones no parecen ser muy sensibles a los efectos nefrotóxicos en comparación con las ratas. En los riñones de ratón se observaron pocos cambios histológicos por exposición a dosis altas. El hígado también fue el principal órgano diana en ratones. La patología es similar a la de las ratas, con apoptosis e hiperplasia hepatocelular. [6] La fumonisina B 1 es posiblemente embriotóxica si la dosis es tóxica para la madre. Varios estudios sobre genotoxicidad no indicaron efectos mutagénicos. Aunque la fumonisina podría dañar el ADN directamente mediante la producción de especies reactivas de oxígeno. [6] Los embriones de ratón fueron expuestos a FB 1 y mostraron inhibición de la síntesis y el crecimiento de esfingolípidos. Esto provocó defectos del tubo neural. La captación de ácido fólico se vio drásticamente inhibida. El tratamiento después de la exposición con ácido fólico redujo los defectos del tubo neural en un 50-65%. [6]
El Programa Internacional de Seguridad Química de la Organización Mundial de la Salud y el Comité Científico de Alimentos de la Comisión Europea han evaluado los riesgos de la fumonisina B1 y han determinado que la ingesta diaria tolerable de FB1, FB2 y FB3, solas o en combinación, es de 2 μg/kg de peso corporal. [15]
Se cree que la inhibición de la ceramida sintasa por FB 1 es reversible, ya que la unión se forma por interacciones no covalentes. Los factores que probablemente inducirán esta reversibilidad son la reducción de la concentración celular de FB 1 y el aumento de las concentraciones celulares de los sustratos para la ceramida sintasa. [13] Además, la tasa de eliminación de la esfinganina y la esfingosina acumuladas afectará la desintoxicación. La información sobre el metabolismo y la biotransformación de FB 1 es muy escasa. Sin embargo, es más probable que el metabolismo ocurra en el intestino, ya que se recuperó FB 1 parcialmente hidrolizado y totalmente hidrolizado en las heces, pero no en la bilis de los monos vervet. [8] La biodisponibilidad de FB 1 se puede reducir tratando el maíz contaminado con fumonisinas con glucomananos extraídos de la pared celular de la levadura Saccharomyces cerevisiae. Estos polisacáridos pueden unirse a ciertas micotoxinas y tienen una capacidad de unión del 67% para las fumonisinas. [25]
{{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda )