

La estructura secundaria de un ácido nucleico es la interacción de pares de bases dentro de un único polímero de ácido nucleico o entre dos polímeros. Puede representarse como una lista de bases que están emparejadas en una molécula de ácido nucleico. [1]
Las estructuras secundarias de los ADN y ARN biológicos tienden a ser diferentes: el ADN biológico existe principalmente como hélices dobles con pares de bases completos , mientras que el ARN biológico es monocatenario y a menudo forma interacciones de pares de bases complejas e intrincadas debido a su mayor capacidad para formar enlaces de hidrógeno que surgen del grupo hidroxilo adicional en el azúcar ribosa . [ cita requerida ]
En un contexto no biológico, la estructura secundaria es una consideración vital en el diseño de estructuras de ácidos nucleicos para la nanotecnología del ADN y la computación del ADN , ya que el patrón de apareamiento de bases determina en última instancia la estructura general de las moléculas.
En biología molecular , dos nucleótidos en cadenas complementarias opuestas de ADN o ARN que están conectadas a través de enlaces de hidrógeno se denominan par de bases (a menudo abreviado bp). En el apareamiento de bases Watson-Crick canónico, la adenina (A) forma un par de bases con timina (T) y la guanina (G) forma uno con citosina (C) en el ADN. En el ARN, la timina es reemplazada por uracilo (U). También ocurren patrones alternativos de enlaces de hidrógeno, como el par de bases de bamboleo y el par de bases de Hoogsteen , particularmente en el ARN, dando lugar a estructuras terciarias complejas y funcionales . Es importante destacar que el apareamiento es el mecanismo por el cual los codones en las moléculas de ARN mensajero son reconocidos por anticodones en el ARN de transferencia durante la traducción de proteínas . Algunas enzimas de unión al ADN o ARN pueden reconocer patrones específicos de apareamiento de bases que identifican regiones reguladoras particulares de los genes. El enlace de hidrógeno es el mecanismo químico que subyace a las reglas de apareamiento de bases descritas anteriormente. La correspondencia geométrica adecuada de los donantes y aceptores de enlaces de hidrógeno permite que solo los pares "adecuados" se formen de manera estable. El ADN con un alto contenido de GC es más estable que el ADN con un bajo contenido de GC , pero contrariamente a la creencia popular, los enlaces de hidrógeno no estabilizan el ADN de manera significativa y la estabilización se debe principalmente a interacciones de apilamiento . [2]
Las nucleobases más grandes , adenina y guanina, son miembros de una clase de estructuras químicas de doble anillo llamadas purinas ; las nucleobases más pequeñas, citosina y timina (y uracilo), son miembros de una clase de estructuras químicas de un solo anillo llamadas pirimidinas . Las purinas solo son complementarias con las pirimidinas: los emparejamientos pirimidina-pirimidina son energéticamente desfavorables porque las moléculas están demasiado separadas para que se establezcan enlaces de hidrógeno; los emparejamientos purina-purina son energéticamente desfavorables porque las moléculas están demasiado cerca, lo que lleva a una repulsión por superposición. Los únicos otros emparejamientos posibles son GT y AC; estos emparejamientos son desajustes porque el patrón de donantes y aceptores de hidrógeno no se corresponde. El par de bases oscilantes GU , con dos enlaces de hidrógeno, ocurre con bastante frecuencia en el ARN .
La hibridación es el proceso de unión de pares de bases complementarios para formar una doble hélice . La fusión es el proceso por el cual se rompen las interacciones entre las hebras de la doble hélice, separando las dos hebras de ácido nucleico. Estos enlaces son débiles y se separan fácilmente mediante un calentamiento suave, enzimas o fuerza física. La fusión se produce preferentemente en ciertos puntos del ácido nucleico. [3] Las secuencias ricas en T y A se funden más fácilmente que las regiones ricas en C y G. Los pasos de bases particulares también son susceptibles a la fusión del ADN, particularmente los pasos de bases TA y TG . [4] Estas características mecánicas se reflejan en el uso de secuencias como TATAA al comienzo de muchos genes para ayudar a la ARN polimerasa a fundir el ADN para la transcripción.
La separación de las hebras mediante un calentamiento suave, como se utiliza en la PCR , es sencilla siempre que las moléculas tengan menos de unos 10.000 pares de bases (10 kilopares de bases o 10 kbp). El entrelazamiento de las hebras de ADN hace que los segmentos largos sean difíciles de separar. La célula evita este problema permitiendo que sus enzimas de fusión del ADN ( helicasas ) trabajen simultáneamente con las topoisomerasas , que pueden escindir químicamente la cadena principal de fosfato de una de las hebras para que pueda girar alrededor de la otra. Las helicasas desenrollan las hebras para facilitar el avance de las enzimas de lectura de secuencias, como la ADN polimerasa .

La estructura secundaria de los ácidos nucleicos se divide generalmente en hélices (pares de bases contiguos) y varios tipos de bucles (nucleótidos no apareados rodeados de hélices). Con frecuencia, estos elementos, o combinaciones de ellos, se clasifican en categorías adicionales que incluyen, por ejemplo, tetraloops , pseudoknots y stem-loops . Se pueden utilizar enfoques topológicos para categorizar y comparar estructuras complejas que surgen de la combinación de estos elementos en diversas disposiciones.
La doble hélice es una estructura terciaria importante en las moléculas de ácidos nucleicos que está íntimamente relacionada con la estructura secundaria de la molécula. Una doble hélice está formada por regiones de muchos pares de bases consecutivos.
La doble hélice de los ácidos nucleicos es un polímero en espiral, generalmente dextrógiro, que contiene dos cadenas de nucleótidos que se aparean entre sí. Una sola vuelta de la hélice constituye unos diez nucleótidos y contiene un surco mayor y un surco menor, siendo el surco mayor más ancho que el surco menor. [5] Dada la diferencia de ancho del surco mayor y el surco menor, muchas proteínas que se unen al ADN lo hacen a través del surco mayor más ancho. [6] Son posibles muchas formas de doble hélice; para el ADN, las tres formas biológicamente relevantes son A-ADN , B-ADN y Z-ADN , mientras que las dobles hélices de ARN tienen estructuras similares a la forma A del ADN.

La estructura secundaria de las moléculas de ácido nucleico a menudo se puede descomponer de forma única en tallos y bucles. La estructura de tallo-bucle (también conocida como "horquilla"), en la que una hélice con bases apareadas termina en un bucle corto no apareado, es extremadamente común y es un componente básico para motivos estructurales más grandes, como las estructuras de hoja de trébol, que son uniones de cuatro hélices como las que se encuentran en el ARN de transferencia . Los bucles internos (una serie corta de bases no apareadas en una hélice apareada más larga) y las protuberancias (regiones en las que una hebra de una hélice tiene bases insertadas "adicionales" sin contrapartes en la hebra opuesta) también son frecuentes.
Existen muchos elementos de estructura secundaria de importancia funcional para los ARN biológicos; algunos ejemplos famosos son los tallos-bucles terminadores independientes de Rho y el trébol del ARNt . Se están llevando a cabo investigaciones activas para determinar la estructura secundaria de las moléculas de ARN, con enfoques que incluyen métodos tanto experimentales como computacionales (consulte también la Lista de software de predicción de la estructura del ARN ).
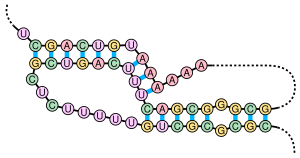
Un pseudonudo es una estructura secundaria de ácido nucleico que contiene al menos dos estructuras de tallo-bucle en las que la mitad de un tallo está intercalada entre las dos mitades de otro tallo. Los pseudonudos se pliegan en conformaciones tridimensionales con forma de nudo, pero no son verdaderos nudos topológicos . El apareamiento de bases en pseudonudos no está bien anidado; es decir, se producen pares de bases que se "superponen" entre sí en la posición de secuencia. Esto hace que la presencia de pseudonudos generales en secuencias de ácidos nucleicos sea imposible de predecir mediante el método estándar de programación dinámica , que utiliza un sistema de puntuación recursivo para identificar tallos pareados y, en consecuencia, no puede detectar pares de bases no anidados con algoritmos comunes. Sin embargo, se pueden predecir subclases limitadas de pseudonudos utilizando programas dinámicos modificados. [8] Las técnicas de predicción de estructura más nuevas, como las gramáticas estocásticas libres de contexto, tampoco pueden considerar pseudonudos.
Los pseudonudos pueden formar una variedad de estructuras con actividad catalítica [9] y varios procesos biológicos importantes dependen de moléculas de ARN que forman pseudonudos. Por ejemplo, el componente de ARN de la telomerasa humana contiene un pseudonudo que es crítico para su actividad. [7] La ribozima del virus de la hepatitis delta es un ejemplo bien conocido de un ARN catalítico con un pseudonudo en su sitio activo. [10] [11] Aunque el ADN también puede formar pseudonudos, generalmente no están presentes en condiciones fisiológicas estándar .
La mayoría de los métodos para la predicción de la estructura secundaria de los ácidos nucleicos se basan en un modelo termodinámico del vecino más cercano. [12] [13] Un método común para determinar las estructuras más probables dada una secuencia de nucleótidos hace uso de un algoritmo de programación dinámica que busca encontrar estructuras con baja energía libre. [14] Los algoritmos de programación dinámica a menudo prohíben los pseudonudos u otros casos en los que los pares de bases no están completamente anidados, ya que considerar estas estructuras se vuelve computacionalmente muy costoso incluso para moléculas de ácidos nucleicos pequeñas. También se pueden utilizar otros métodos, como las gramáticas estocásticas libres de contexto para predecir la estructura secundaria de los ácidos nucleicos.
En el caso de muchas moléculas de ARN, la estructura secundaria es muy importante para el correcto funcionamiento del ARN, a menudo más que la secuencia real. Este hecho ayuda en el análisis del ARN no codificante , a veces denominado "genes de ARN". Una aplicación de la bioinformática utiliza las estructuras secundarias de ARN predichas para buscar en un genoma formas de ARN no codificantes pero funcionales. Por ejemplo, los microARN tienen estructuras canónicas de tallo-bucle largas interrumpidas por pequeños bucles internos.
La estructura secundaria del ARN se aplica en el empalme del ARN en ciertas especies. En los seres humanos y otros tetrápodos, se ha demostrado que sin la proteína U2AF2 , el proceso de empalme se inhibe. Sin embargo, en el pez cebra y otros teleósteos, el proceso de empalme del ARN todavía puede ocurrir en ciertos genes en ausencia de U2AF2. Esto puede deberse a que el 10% de los genes en el pez cebra tienen pares de bases TG y AC alternados en el sitio de empalme 3' (3'ss) y el sitio de empalme 5' (5'ss) respectivamente en cada intrón, lo que altera la estructura secundaria del ARN. Esto sugiere que la estructura secundaria del ARN puede influir en el empalme, potencialmente sin el uso de proteínas como U2AF2 que se ha pensado que son necesarias para que se produzca el empalme. [15]
La estructura secundaria del ARN se puede determinar a partir de las coordenadas atómicas (estructura terciaria) obtenidas mediante cristalografía de rayos X , que a menudo se encuentran depositadas en el Protein Data Bank . Los métodos actuales incluyen 3DNA/DSSR [16] y MC-annotate. [17]