La Κ-caseína , o kappa caseína , es una proteína de la leche de mamíferos que interviene en varios procesos fisiológicos importantes. La quimosina (presente en el cuajo ) divide la K-caseína en un péptido insoluble (para kappa-caseína) y un glicomacropéptido soluble en agua (GMP). El GMP es responsable de una mayor eficiencia de la digestión, la prevención de la hipersensibilidad de los neonatos a las proteínas ingeridas y la inhibición de los patógenos gástricos. [1] El gen humano de la κ-caseína es CSN3 .

Las caseínas son una familia de fosfoproteínas ( αS1 , αS2, β , κ) que representan casi el 80% de las proteínas de la leche bovina [3] y que forman agregados solubles conocidos como "micelas de caseína" en las que las moléculas de κ-caseína estabilizan la estructura. Existen varios modelos que dan cuenta de la conformación espacial de la caseína en las micelas. [4] Uno de ellos propone que el núcleo micelar está formado por varias submicelas, consistiendo la periferia en microvellosidades de κ-caseína [5] [6] Otro modelo sugiere que el núcleo está formado por fibrillas interconectadas de caseína. [7] Finalmente, el modelo más reciente [8] propone un doble enlace entre las caseínas para que se produzca la gelificación. Los 3 modelos consideran a las micelas como partículas coloidales formadas por agregados de caseína envueltos en moléculas solubles de κ-caseína. Las proteasas que coagulan la leche actúan sobre la porción soluble, κ-caseína, originando así un estado micelar inestable que da lugar a la formación de coágulos. [9]

La quimosina (EC 3.4.23.4) es una proteasa aspártica que hidroliza específicamente el enlace peptídico en Phe105-Met106 de la κ-caseína y se considera la proteasa más eficiente para la industria quesera . [10] Sin embargo, existen proteasas coagulantes de la leche capaces de escindir otros enlaces peptídicos en la cadena de κ-caseína, como la endotiapepsina producida por Endothia parasitica . [11] También existen varias proteasas coagulantes de la leche que, siendo capaces de escindir el enlace Phe105-Met106 en la molécula de κ-caseína, también escinden otros enlaces peptídicos en otras caseínas, como las producidas por Cynara cardunculus [6] [12] [13] o incluso la quimosina bovina. [14] Esto permite la fabricación de diferentes quesos con variedad de propiedades reológicas y organolépticas.
El proceso de coagulación de la leche consta de tres fases principales: [15]
Cada paso sigue un patrón cinético diferente , siendo el paso limitante en la coagulación de la leche la tasa de degradación de la κ-caseína. El patrón cinético del segundo paso del proceso de coagulación de la leche está influenciado por la naturaleza cooperativa de la floculación micelar, [16] [13] mientras que las propiedades reológicas del gel formado dependen del tipo de acción de las proteasas, el tipo de leche y los patrones de proteólisis de la caseína. [13] El proceso general está influenciado por varios factores diferentes, como el pH o la temperatura. [12] [9]
La forma convencional de cuantificar una enzima coagulante de la leche dada [17] emplea la leche como sustrato y determina el tiempo transcurrido antes de la aparición de coágulos de leche. Sin embargo, la coagulación de la leche puede tener lugar sin la participación de las enzimas debido a variaciones en los factores fisicoquímicos, como el pH bajo o la temperatura alta. [6] [3] [9] En consecuencia, esto puede conducir a resultados confusos e irreproducibles, particularmente cuando las enzimas tienen baja actividad. Al mismo tiempo, el método clásico no es lo suficientemente específico, en términos de establecer el inicio preciso de la gelificación de la leche, de modo que la determinación de las unidades enzimáticas involucradas se vuelve difícil y poco clara. Además, aunque se ha informado que la hidrólisis de κ-caseína sigue la cinética típica de Michaelis-Menten , [15] es difícil de determinar con el ensayo clásico de coagulación de la leche.
Para superar esto, se han propuesto varios métodos alternativos, como la determinación del diámetro del halo en la leche gelificada en agar, [17] la medición colorimétrica, [18] o la determinación de la tasa de degradación de la caseína previamente marcada con un trazador radiactivo [19] o un compuesto fluorocromo . [20] Todos estos métodos utilizan la caseína como sustrato para cuantificar las actividades proteolíticas o de coagulación de la leche.
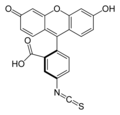
La Κ-caseína se marca con el fluorocromo isotiocianato de fluoresceína ( FITC ) para producir el derivado de tiocarbamoilo de fluoresceína ( FTC ). Este sustrato se utiliza para determinar la actividad de coagulación de la leche de las proteasas. [21]
El método FTC-κ-caseína permite determinar de forma precisa y exacta la degradación de la κ-caseinolítica, el primer paso en el proceso de coagulación de la leche. Este método es el resultado de una modificación del descrito por SS Twining (1984). La principal modificación fue sustituir el sustrato utilizado anteriormente ( caseína ) por κ-caseína marcada con el fluorocromo isotiocianato de fluoresceína (FITC) para obtener el derivado fluoresceína tiocarbamoil (FTC). Esta variación permite cuantificar las moléculas de κ-caseína degradadas de una forma más precisa y específica, detectando sólo aquellas enzimas capaces de degradar dichas moléculas. El método descrito por Twining (1984), sin embargo, fue diseñado para detectar la actividad proteolítica de una variedad considerablemente mayor de enzimas. FTC-κ-caseína permite la detección de diferentes tipos de proteasas a niveles en los que aún no es evidente la coagulación de la leche, demostrando su mayor sensibilidad sobre los procedimientos de ensayo utilizados actualmente. Por lo tanto, el método puede encontrar aplicación como indicador durante la purificación o caracterización de nuevas enzimas de coagulación de la leche.